REVISÃO PARA O
ENEM !
01. (UEMS). Uma
solução A possui pH = 2 e uma solução B possui pH = 12. É correto dizer que:
a)
a solução A é ácida enquanto que B é alcalina.
b)
a solução A possui maior quantidade de íons hidroxilas que a solução B.
c)
o pH da solução B deverá baixar com a adição de íons hidroxilas.
d)
a solução B é ácida enquanto que a solução A é básica.
e)
misturando-se quantidades iguais da solução A com a solução B, a solução A irá
baixar seu pH.
02. (Unifor-CE). Considere
a seguinte tabela:
Para
saber o pH de uma solução adicionou-se a quatro tubos de ensaio contendo uma
pequena quantidade da solução em cada um, algumas gotas de indicadores,
anotando a cor resultante na solução.
Pode-se
afirmar, em relação ao pH da referida solução, que
a)
é menor que 3,0
b)
está entre 3,3 e 4,2
c)
está entre 4,6 e 6,0
d)
está entre 6,0 e 7,0
e)
é igual a 7,0
03. (UFRN) O pH
tem uma importância significativa nos processos de laboratório, da indústria e
dos organismos vivos. Ele pode ser avaliado de forma simples, usando-se
substâncias chamadas indicadores. O indicador ácido-base alaranjado de metila
tem o intervalo de viragem (mudança de coloração) como o que se apresenta na
figura a seguir, que indica a cor em função do pH:
As
figuras abaixo apresentam soluções com as respectivas concentrações de OH–.
Quando
são colocadas gotas do indicador em cada uma das soluções, a que se torna
vermelha é a:
a)
I
b)
II
c)
III
d)
IV
04. (Cefet-RJ) A
massa, em gramas, de hidróxido de sódio, necessária para preparar 400 mL de uma
solução da mesma base, com pH 10, é:
a)
4,0 g.
b)
1,6 g.
c)
4,0 x 10–5 g.
d)
1,6 x 10–3 g.
e)
1,6 x 10–9 g.
05. (UFR-RJ) Em um
potenciômetro, se faz a leitura de uma solução 0,001 M de hidróxido de sódio (utilizado
na neutralização do ácido lático). Sabendo-se que o grau de dissociação é total,
o valor do pH encontrado corresponde a:
a)
2,7.
b)
5,4.
c)
12,0.
d)
11,0
e)
9,6.
06. Uma solução C, da
qual se quer determinar o caráter ácido-base, é dividida em três partes: C2 e
C3. À solução C1 são adicionadas algumas gotas de amarelo de alizarina, que a tornam
amarela. À C2 são adicionadas algumas gotas de suco de uvas, que a tornam
verde. Com
base nessas informações, é correto afirmar, a respeito da solução C:
a)
é uma solução neutra.
b)
é uma solução ácida.
c)
é uma solução básica.
d) seu pH está entre 6,5 e 10.
e)
seu pH é menor que 6,5.
07. À solução C3 são adicionadas algumas
gotas do indicador extraído do tomate, que a tornam amarela. Com base em todas
as informações a respeito da solução C, é correto afirmar sobre ela:
a)
seu pH está entre 8,5 e 14.
b)
é uma solução ácida, de pH igual a 6,5.
c)
é uma solução básica, de pH inferior a 8,5.
d)
seu pH está entre 6,5 e 8,5.
e)
seu pH está entre 8,5 e 10.
08. (PUC-PR). Efetuou-se
a dissolução de 6,3 miligramas de HNO3 em água suficiente para 500 ml de
solução. Calcule o pH mais aproximado desta solução.
Dados:
M(H)
= 1,00 g/mol
M(O)
= 16,00 g/mol
M(N)
= 14,00 g/mol
log
2 = 0,30
a)
4,00.
b)
2,69.
c)
1,69.
d)
0,69.
e) 3,69.
09. (Ita-SP). A 25 °C, adiciona-se 1,0 mL de uma solução
aquosa 0,10 mol/L em HCl a 100 mL de uma solução aquosa 1,0 mol/L em HCl. O pH
da mistura final é
a)
0
b)
1
c)
2
d)
3
e)
4
10. (UFMS). O
valor da concentração hidrogeniônica, [H+], do sangue, quando medido a 25 °C, é 4,5 x 10–8 mol/L. Com base no dado
acima, é correto afirmar que
Dados: log
2,2 = 0,34 log 4,5 = 0,65
(01)
[OH–] = 1,0 x 10–14 mol/L – 4,5 x 10–8 mol/L.
(02)
[OH–] = 1,0 x 10–14 mol/L – 4,5 x 10–8 mol/L.
(04)
[OH–] = 2,2 x 10–7 mol/L.
(08)
pH < 7, portanto, o sangue está ácido.
(16)
pH > 7, portanto, o sangue está fracamente básico.
(32)
nessa temperatura o sangue é neutro, ou seja, seu pH = 7.
Dê,
como resposta, a soma das alternativas corretas.
Instruções:
Para
responder às questões de números 26 e 27 considere as seguintes informações:
Num
indivíduo com saúde normal o pH do sangue deve estar na faixa de 7,35 a 7,45. A
morte ocorre quando o pH cai abaixo de 6,80 ou sobe acima de 7,80. Na faixa de
7,45 a 7,80 ocorre alcalose e na faixa de 7,35 a 6,80 ocorre acidose.
Dado:
Produto iônico da água = 1 × 10–14
11. (Unifor-CE) No
sangue de certo indivíduo a concentração, em mol/L, de íons H+ (aq) é igual a 1
× 10–7,0. Nesse
caso, conclui-se que o indivíduo em questão está com
a)
forte acidose.
b)
fraca acidose.
c)
forte alcalose.
d)
fraca alcalose.
e)
saúde normal.
12. (Unifor-CE) Num
indivíduo que corre risco de vida por acidose, qual deve ser o valor limite do
pOH do sangue?
a)
6,4
b)
6,8
c)
7,2
d)
7,8
e)
14
13. (U. F. Pelotas-RS). A
indústria de conservas de frutas e hortaliças é a base da economia de Pelotas.
Entre os diversos produtos industrializados no município, destacam-se as
compotas de pêssego e figo.
Nas
compotas de pêssego, o pH da calda está em torno de 4,0 e, nas compotas de
figo, está em torno de 5,0. O pH mais alto da calda, na compota de figo, faz
com que ocorra a possibilidade de proliferação do Clostridium botulinum,
que se desenvolve em meios com pH acima de 5,0.
Considerando
uma calda de compota de pêssego com pH = 4,0 e uma calda de compota de figo com
pH = 5,0, podemos afirmar que
a)
o pOH da calda da compota de pêssego é 9,0 e o da calda da compota de figo é
8,0.
b)
a calda da compota de figo é mais ácida que a da compota de pêssego.
c)
a concentração hidrogeniônica da calda com pH = 4,0 é 10-4 mol/L e da calda com
pH = 5,0 é 10-5 mol/L.
d)
quanto maior o pOH de uma calda de compota, menor será sua concentração
hidrogeniônica.
e)
uma amostra de calda, com concentração de oxidrilas de 10-3 mol/L, tem pH igual
a 3,0.
14.
(UFSC). São dadas as duas
soluções aquosas:
Com
base nas afirmações acima, podemos concluir CORRETAMENTE que:
(01)
A solução “A” apresenta pH = 4, portanto, com caráter ácido.
(02)
A solução “B” apresenta caráter básico e pH = 8.
(04)
A concentração de íons OH–, presentes na solução “A”, é 10–10 mol/L.
(08)
A concentração de íons OH–, presentes na solução “B”, é 10–6 mol/L.
(16)
Adicionando-se 100 mL de água a 100 mL da solução “A”, a nova concentração será
[H+] = 1 · 10–2 mol/L.
(32)
Ao adicionarmos 100 mL de água a 100 mL da solução “A”, a nova solução ficará
mais
ácida.
Dê,
como resposta, a soma das alternativas corretas.
Pelo Prof. Eudo Robson
GABARITO
1-A, 2-C, 3-C, 4-D, 5-D, 6-D, 7-E, 8-E, 9-A, 10-
SOMA=22, 11-A,
12-C, 13-C,14- SOMA=15


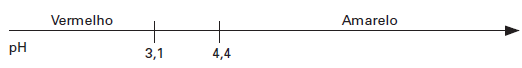


Sem comentários:
Enviar um comentário