. As propriedades podem ser GERAIS ou ESPECÍFICAS.
A – PROPRIEDADES GERAIS
- São aquelas comuns aos diversos tipos de matéria, ou seja, todo material possui.
Como por exemplo, o butano (gás), a água (líquida) e o ouro (sólido) têm todas as propriedades a seguir sendo, portanto impossível serem diferenciados por elas.
A.1 – MASSA
- É a quantidade de matéria de um corpo. Todo material encontrado na terra tem massa, não importa a quantidade, tem massa. É medida em toneladas, quilogramas
e gramas. A massa ao contrário do muitos pensam NÃO é força, tanto é que ela é medida numa balança.
A.2– EXTENSÃO
- É a parte do espaço ocupada por certa porção de matéria. É medida em litros (L). Toda matéria conhecida ocupa um espaço ou seja tem volume não importando se é igual ou não.
A.3 – IMPENETRABILIDADE - Duas porções de matéria (ou dois corpos) não podem ocupar, ao mesmo tempo, o mesmo lugar no espaço. Ex: o gelo quando colocado num copo cheio com água, faz com que o volume que a pedra vai ocupar, provoque o transbordamento do mesmo volume em água que já está no copo ou você pode sentar no lugar de uma pessoa sem que ela sai do lugar?
A.4 – DIVISIBILIDADE - A matéria pode ser dividida em partes cada vez menores, conservando as mesmas propriedades químicas. Ex: uma coca-cola é dividida entre vários alunos, todos beberão a mesma bebida.
A.5 – DESCONTINUIDADE - A matéria é descontínua, isto é, existem espaços entre as moléculas e entre átomos que a constituem. Por isso os átomos se dividem como veremos mais adiante.
A.6 – COMPRESSIBILIDADE - É a propriedade que tem a matéria de, sob a ação de uma força, diminuir de volume pela diminuição dos espaços intra-moleculares. É possível comprimir os sólidos, os líquidos e os gases. Toda matéria é compressível, nós é que não temos a capacidade de ver devidos nossas limitações. Para isso usamos aparelhos de medição científica de alta precisão.
A.7 – ELASTICIDADE - É a capacidade que a matéria possui de voltar à sua forma e volume iniciais, quando cessa a compressão ou tração. Ex.: Uma mola retorna à sua forma e volume ao cessar força que atuava na mesma. Nossa pele quando puxada retorna a forma original, nos esportes vemos as roupas dos atletas de natação e atletismo que se moldam aos corpos. As novas cuecas também seguem este conceito.
A.8 – INÉRCIA - É a tendência que tem a matéria de conservar seu estado de repouso ou de movimento. Ex.: Uma pessoa é projetada para trás quando o motorista de um ônibus acelera e para frente quando freia. Quando um carro dá uma arrancada para frente, quem está dentro vai para trás conservando assim seu estado de repouso. Quando estamos dentro de um carro sentado no banco, as árvores passam por nós, isto significa que, com relação às árvores estamos mantemos nosso estado de movimento.
A.9 –MOBILIDADE
- É o poder de ocupar sucessivamente diferentes posições no espaço (trocar de lugar). As correntes marinhas levam águas em direções diversas, todos os corpos se movem, basta para isso adotarmos um referencial (será estudado em física)
Ex: Eu posso estar na sala de aula e simplesmente sair. Isto é mobilidade.
A.10 –PONDERABILIDADE
- Um corpo quando sujeito a um campo gravitacional, podemos avaliar seu peso, isto é ele pode ser pesado e o instrumento que mede o peso é o Dinamômetro e não a Balança. A unidade mais usada para medir o peso é o N (Newton).
A.11 –INDESTRUTIBILIDADE - A matéria é indestrutível, ela apenas pode ser transformada ou rearranjada. Quando quebramos um copo de vidro, todos os pedaços de vidro continuam com as mesmas propriedades, ou seja, continuam a ser vidro. Nada mudou, apenas o tamanho.
B – PROPRIEDADES ESPECÍFICAS
São aquelas que diferenciam os diversos tipos de matéria, ou seja, com elas podemos diferenciar os diversos tipos de materiais. A água por exemplo, nenhum outro material tem a densidade igual a 1000 Kg/m3. Isto a diferencia de tudo.
As propriedades específicas podem ser:
QUÍMICAS FÍSICAS ORGANOLEPTICAS
B.1 – PROPRIEDADES QUÍMICAS
Serão estudadas ao longo do curso de química.
Ex: Combustão, hidrólise, ácidos, bases, sais e óxidos.
B.1-a) Combustão
É a propriedade que algumas substâncias têm de reagir com o oxigênio do ar. Ex.: o carvão só queima na presença do gás oxigênio, o ferro em contato com o oxigênio enferruja, enquanto o vidro ao ter o mesmo contato, não enferruja (Ou seja, não oxida).
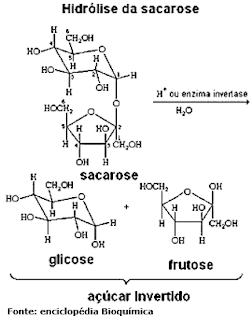
B.1-b) Hidrólise
É a propriedade que algumas substâncias têm de se decompor em suas partes constituintes.
Quando submetidas a reações que contenham água, algumas substâncias se hidrolisam como a quebra da molécula do açúcar pela água produzindo duas moléculas menores...
... outras apenas se dissociam, e ainda temos espécies que ionizam.
Ex.: o ácido clorídrico (ácido muriático) se decompondo na presença da água em hidrogênio e cloro. Nosso organismo, entretanto, possui enzimas para promover a hidrólise de outros oligossacarídeos ou polissacarídeos.
B.2 – PROPRIEDADES FÍSICAS
São as propriedades medidas experimentalmente e dadas por valores numéricos aos quais chamamos constantes físicas. As principais são: ponto de fusão, ponto de ebulição, densidade, dureza, tenacidade, estado físico, condutibilidade térmica e elétrica, solubilidade, calor específico, magnetismo, maleabilidade e ductilidade.
Vejamos o que vem a ser dureza, tenacidade e densidade.
B.2-a) DUREZA
É a resistência que a superfície de um material oferece ao risco. Pense no seguinte: Você pega um giz e escreve num quadro. Quem se desgastou? Diminuiu de tamanho? O quadro? Ou o giz? Pronto, aquele que se desgasta é o mais mole, enquanto o outro é o de maior dureza (mais duro). Notem o piso de porcelanato, você anda por ele e ele não arranha, o que isto significa? Que ele é mais duro do que o solado do seu sapato.
Para melhor entendermos a dureza, necessário se faz conhecer a escala de Friedrich Mohs .
A ESCALA DE MOHS (em valores relativos)

B.2-b) CLIVAGEM
Se um mineral tiver essa propriedade, pode se quebrar em superfícies planas e lisas se sofrer impacto. Isso é reflexo de sua estrutura cristalina interna. Há minerais que apresentam apenas um plano de clivagem, como a mica, que se quebra sempre em planos paralelos a uma única direção no espaço. Outros minerais, como os minerais do grupo do feldspato, apresentam dois planos de clivagem. Outros ainda, como a calcita, apresentam três direções de clivagem perfeita, o que determina que, num cristal quebrado, cada fragmento terá a mesma forma romboédrica do cristal inicial.
B.2-c) TENACIDADE
- É a resistência que o material oferece ao impacto. Devemos atentar para o fato de dureza não garantir tenacidade. Podemos adicionar substâncias aos metais (ligas) e às matérias plásticas para que estes apresentem maior tenacidade.
Ex.: A adição do manganês em quantidades entre 0.3 a 1%, permite extrair o Oxigênio dos aços, evitando a formação de óxidos indesejáveis. Essa mesma função desoxidante é também obtida com a adição do Silício (Si), o qual ainda propicia maior tenacidade ao aço. O diamante é o mineral mais duro, porém, não é tenaz.
Neste gráfico notamos que o Níquel é menos tenaz a temperatura baixa.
B.2-d) DENSIDADE
É a relação entre a massa e o volume ocupado pela matéria.Podemos calcular a densidade através da fórmula:
Obs.: A densidade da água pura a 4oC e sob pressão normal (1 atmosfera) é 1g/cm3. No Sistema Internacional a unidade de densidade é Kg/m3.
Ex1: Determine a densidade de um corpo cujo massa é 60 g e cujo o volume é 500 mL.
Resolução:
d = ?
m = 60 g; d = m / V d = 60 g / 500 mL
V = 500 mL d = 0,12 g / mL
Ex2: Calcular a massa, em gramas, de um objeto que apresenta volume de 3 litros e densidade de 0,5 Kg/L.
Resolução:
m = ?
d = 0,5 Kg / L; d = m / V → m = d x V
V = 3 litros m = 0,5 Kg / L x 3 L
1,5 Kg x 1000 g / 1 Kg
m = 1500 g
Ex3: Determine o volume, em litros, ocupado por um corpo de densidade 2 g / cm3, sabendo que sua massa é igual a 6 Kg.
Resolução:
V = ?
m = 6 Kg x 1000 g / 1 Kg = 6000 g
d = 2 g / cm3
d = m / V
V = m / d
V = 6000 g / 2 g / cm3
V = 3000 cm3 x 1 L / 1000 cm3
V = 3 L
Ex4: Qual a massa de um bloco de ferro maciço que tem o formato de um cubo, cuja aresta (segmento de reta determinado pela interseção de dois lados) é 5 cm, sabendo que a densidade do ferro é igual a 7,8 g / cm3?
Resolução:
m = ?
d = 7,8 g / cm3
V = 5 cm x 5 cm x 5 cm = 125 cm3
d = m / V
m = d x V
m = 7,8 g / cm3 x 125 cm3
m = 975 g x 1 Kg / 1000 g
m = 0,975 Kg
Ex5: A densidade do óleo é de 0,80 g / cm3. Determine: A massa de óleo contido em uma lata de 900 mL. Qual o número de latas que pode ser preenchida com 360 Kg de óleo?
Resolução:
m = ?
d = 0,80 g / cm3
V = 900 mL = 900 cm3
d = m / V
m = d x V m = 0,80 g / cm3 x 900 cm3
m = 720 g / 1000 g
m = 0,72 Kg
b) n.º de latas =?
1 lata
0,72 Kg x latas
360 Kg x latas x 0,72 =
360 x latas =
360 / 0,72 x latas = 500
B.3– PROPRIEDADES ORGANOLÉPTICAS - São aquelas percebidas pelos nossos sentidos, visão, audição, olfato, paladar e tato. Ex.: cor, brilho, sabor e odor.
Vejamos o que vem a ser cada uma delas.
B3.1 – COR - É a propriedade percebida pela visão. De acordo com ela as substâncias podem ser:
Incolores - não apresentam cor. Ex.: água, álcool, acetona, éter, diamante, ar despoluído, o vidro a base de sílica....
Coloridas - apresentam cor. Ex.: o ouro (amarelo), o iodo (violeta) e o sal de cozinha (não é branco), enxofre (amarelo), esmaltes ...
B3.2 – BRILHO - É a capacidade que a matéria possui de refletir a luz que incide sobre ela.
As Leis da Reflexão
1.ª Lei - O raio incidente, o raio refletido e a normal ao espelho no ponto de incidência estão no mesmo plano;
2.ª Lei - O ângulo de incidência é igual ao ângulo de reflexão.
Quando a matéria não reflete a luz, ou reflete muito pouco, dizemos que a matéria é fosca, do contrário dizemos que ocorre refração. Ex. os metais brilham quando polidos, a madeira, as peles de animais e os tecidos não brilham.
A luz quando incide na água de uma piscina, ela desvia seu raio, atravessando de modo a refratar a luz. Ex: Quando vemos uma vareta num copo de água.
B3.3 – SABOR É a propriedade percebida pelo paladar. Diante disto a matéria pode ser:
Insípidas - quando não possuem sabor. Ex.: água destilada, gás hidrogênio, vidro, ...
Sápidas - quando têm sabor. Ex.: açúcar, sal, vinagre, álcool, gasolina, ar poluído, madeira ...
B3.4 – ODOR É a propriedade percebida pelo olfato. Diante disto a matéria pode ser:
Odoríferas - quando possuem cheiro. Ex.: perfume, amoníaco, álcool, éter, gasolina, vinagre, ...
Inodoras – quando não possuem cheiro Ex.: água, gás hidrogênio, vidro...
Pelo Prof. Eudo Robson