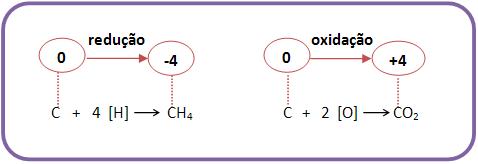
01. Na
equação representativa de uma reação de oxi-redução:
Ni + Cu 2+ → Ni2+
+ Cu
a) O íon Cu2+ é o oxidante porque ele é oxidado.
b) O íon Cu2+ é o redutor porque ele é reduzido.
c) O Ni é redutor porque ele é oxidado.
d) O Ni é o oxidante porque ele é
oxidado.
e) O Ni é o oxidante e o íon Cu2+ é o redutor.
02. Na reação de
oxi-redução H2S + I2 →
S + 2HI, as variações dos números de oxidação do enxofre e do
iodo são, respectivamente:
a) +2 para zero e zero para +1.
b) zero para +2 e +1 para zero.
c) zero para -2 e -1 para zero.
d) zero para -1 e -1 para zero.
e) –2 para zero e zero para -1.
03. Para
uma reação de óxido-redução:
a) o agente redutor sofre redução.
b) a substância que perde o elétron é o
agente redutor.
c) o número de oxidação do agente
oxidante aumenta.
d) o número de oxidação do agente
redutor diminui.
e) a substância que perde elétron é o
agente oxidante.
04. O
elemento X reage com o elemento Z, conforme o processo:
Z3– + X → Z1– +
X2–
Nesse processo:
a) Z ganha elétrons de X.
b) X ganha elétrons de Z.
c) X e Z cedem elétrons.
d) X e Z perdem elétrons.
e) X e Z cedem e ganham elétrons,
respectivamente.
05. (Mogi-SP). O
número de oxidação do manganês no permanganato de potássio (KMnO4)
é:
a) +2
b) +3
c) +5
d) +7
e) – 8
06. (Vunesp).
Indique, dentre as substâncias apresentadas, a que contém nitrogênio com número
de oxidação mais elevado.
a) N2
b) NaN3
c) N2O3
d) NH4Cl
e) HNO3
07. (Vunesp). O
filme Erin Brockowich é baseado num fato,em que o emprego de crômio hexavalente numa usina
termoelétrica provocou um número elevado de casos de câncer entre os habitantes
de uma cidade vizinha. Com base somente nessa informação, dentre os compostos de
fórmulas
CrCl3 CrO3 Cr2O3 K2CrO4 K2Cr2O7
(1) (2) (3) (4) (5)
pode-se
afirmar que não seriam
potencialmente cancerígenos:
a) o composto 1, apenas.
b) o composto 2, apenas.
c) os compostos 1 e 3, apenas.
d) os compostos 1, 2 e 3, apenas.
e) os compostos 2, 4 e 5, apenas.
08. (Vunesp). Nas
substâncias CaCO3, CaC2, CO2, C (grafite) e CH4,
os números de oxidação do carbono são, respectivamente:
a) -4 +1 +4 0 +4
b) +4 -1 +4 0 -4
c) -4 -2 0 +4 +4
d) +2 -2 +4 0 -4
e)
+4 +4 +4 +4 +4
09. (U. Católica de Brasília-DF). Numa transformação química, o estanho teve seu número de oxidação
aumentado em quatro unidades, segundo a equação:
Sn
--------- Sn+4
Sn+4
Nessa equação, o estanho:
a) ganhou quatro prótons.
b) ganhou quatro elétrons.
c) perdeu quatro prótons.
d) perdeu quatro elétrons.
e) perdeu dois prótons e dois elétrons.
10. (PUC-RS). Em
relação à equação de oxidação-redução não balanceada Fe° + CuSO4 ------
Fe2(SO4)3 + Cu°, pode-se
afirmar que o:
a) número de oxidação do cobre no sulfato cúprico é "1.
b) átomo de ferro perde 2 elétrons.
c) cobre sofre oxidação.
d) ferro é o agente oxidante.
e)
ferro sofre oxidação.
11. (U. F. Viçosa-MG). A substância na qual o manganês apresenta maior número de oxidação
é:
a) K2MnO4
b)
KMnO4
c)
MnO2
d)
Mn
e)
MnSO4
12. (Ufac). Na seguinte
equação química:
Zn (s)
+
2 HCl (aq) --------- ZnCl2 (aq) + H2 (g)
a) o elemento Zn (s) oxida-se e reage como agente oxidante.
b) o elemento Zn (s) oxida-se e reage como agente
redutor.
c) o elemento Zn (s) reduz-se e reage como agente
redutor.
d) o HCl (ácido clorídrico) é um agente redutor.
e) a equação é classificada como reversível.
13. O enxofre é um sólido amarelo encontrado livre na natureza em regiões
onde ocorrem fenômenos vulcânicos. As suas variedades alotrópicas são o rômbico
e o monoclínico. Esse elemento participa de várias substâncias e íons, tais
como:
S8, H2S, SO2, H2SO4,
H2SO3, SO3, SO42- e Al2(SO4)3.
Determine os Nox do enxofre em cada uma dessas
espécies químicas.
14. (Puccamp – SP). Descobertas recentes da Medicina indicam a
eficiência do óxido nítrico (NO) no tratamento de determinado tipo de
pneumonia. Sendo facilmente oxidado pelo oxigênio e NO2, quando
preparado em laboratório, o ácido nítrico deve ser recolhido em meio que não
contenha O2. Os números de oxidação do nitrogênio no NO e NO2 são, respectivamente:
a) + 3 e + 6.
b) + 2 e + 4.
c) + 2 e + 2.
d) zero e + 4.
e) zero e + 2.
15. Para responder à questão considere a
seguinte experiência feita com materiais caseiros. Quatro conjuntos iguais a este foram
montados, variando-se o material "x", a saber:
Os
conjuntos foram deixados em repouso por alguns dias à temperatura ambiente e
observações diárias foram feitas. Durante todo o período de observação, átomos
de ferro não sofreram alteração de seu número de oxidação, SOMENTE em
a)
1
b)
4
c)
1 e 4
d)
2 e 3
e)
2 e 4
16. Uma reação de importância comercial e
que emprega água é a redução do vapor por meio de coque a altas temperaturas: C
+ HOH ------ CO + H2‚ à temperatura de 1000°C. A mistura de monóxido
de carbono e gás hidrogênio denominada gás d'água constitui um combustível
satisfatório onde o gás natural não existe ou é mais caro. Diante do exposto,
julgue os itens.
(
)
O coque (C) nesta importante reação está sendo reduzido, sendo portante agente
oxidante.
(
)
Na redução do vapor d'água e altas temperaturas pelo coque, além de produzir
gás de importância comercial, reduz o hidrogênio de +1 para 0 (zero).
(
)
Esta importante reação comercial trata-se de uma reação redox, pois está
ocorrendo oxidação e redução ao mesmo tempo.
(
) O oxigênio é o único elemento nesta
reação que não sofre variação no seu estado de oxidação.
17. (Uerj). O formol ou formalina é uma solução
aquosa de metanal, utilizada na conservação dos tecidos de animais e cadáveres
humanos para estudos em Biologia e Medicina. Ele é oxidado a ácido fórmico,
segundo a equação a seguir, para evitar que os tecidos animais sofram
deterioração ou oxidação.
Nessa
transformação, o número de oxidação do carbono sofreu uma variação de:
a)
- 4 para + 4
b)
- 3 para - 2
c)
- 2 para - 1
d)
0 para + 2
18. O nitrogênio é importantíssimo para a
vida na Terra. No entanto, para que entre nos ciclos biológicos é fundamental
que ele seja transformado, a partir da atmosfera, em substâncias aproveitáveis
pelos organismos vivos. O diagrama a seguir mostra, de modo simples, o seu
ciclo na Terra. Os retângulos representam os reservatórios naturais contendo
quantidades de compostos de nitrogênio. No diagrama estão representados os
processos envolvidos, as quantidades totais de nitrogênio e, em cada retângulo,
as espécies predominantes.
a)
quais dos processos representam oxidação de uma espécie química em outra?
b)
em qual espécie química desse ciclo o nitrogênio apresenta o maior número de
oxidação? Qual é o seu número de oxidação nesse caso? Mostre como chegou ao
resultado.
c)
qual é o número total de moles de átomos de nitrogênio no sistema representado?
19. Por efeito de
descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da
seqüência de reações representadas a seguir:
I. N2 + O2 ------à 2 NO
II. 2 NO + O2 ------à 2 NO2
III. NO2 + O2 ------à NO + O3
Considerando
as reações no sentido direto, pode-se afirmar que ocorre oxidação do nitrogênio:
a)
apenas em II.
b)
apenas em I e II.
c)
apenas em I e III.
d)
apenas em I.
e)
em I, II e III.
20. (UFSC). Os números de oxidação dos calcogênios (O, S, Se, Te, Po) nos
compostos H2O2, HMnO4, Na2O4 e
F2O são respectivamente:
a) –1, -2, -2, -0,5
b) –1, -2, -0,5, +2
c) –2, -2, -2, -2
d) –0,5, +2, -1, +2
e) –1, -0,5, +1, +2
Pelo Professor Eudo Robson