sábado, 6 de abril de 2019
quinta-feira, 4 de abril de 2019
ESTUDO DOA ALDEÍDOS E DAS CETONAS
ESTUDO DOS ALDEÍDOS E CETONAS
Definição:
- Aldeídos
são compostos orgânicos que possuem o grupo
funcional aldoxila, metanoila
ou formila
na extremidade da cadeia, ligado a um átomo de hidrogênio e a um de oxigênio.
FÓRMULAS GERAIS
Exemplos:
Nomenclaturas de aldeídos
A nomenclatura IUPAC dos aldeídos é feita com a terminação AL. A
cadeia principal é a mais longa que inclui o grupo — CHO, e a numeração é feita a partir desse grupo.
A nomenclatura usual é feita com a palavra aldeído e o nome do hidrocarboneto correspondente.
Exemplos:
Há casos particulares com nomes
próprios:
Benzaldeído
Principais Aldeídos
Aldeído fórmico (formaldeído) que é um gás incolor, de cheiro característico e irritante e
bastante solúvel em água. Sua solução aquosa, a 40%, é conhecida no comércio
como “formol” ou “formalina”.
É usado
como desinfetante, conservante de cadáveres, na fabricação de plásticos, de de
desinfetantes, de remédios (urotropina), de explosivos RDX (ciclonite),
alisantes capilares, é irritante para os olhos, nariz,
garganta e pulmões.
Aldeído Acético está presente na “ressaca” devido a ingestão de bebidas alcoólicas
e no cheiro irritante que escapa dos automóveis movidos a álcool ao lhe darmos
a partida sendo usado na produção de ácido acético (vinagre).
CETONAS
Definição:
É todo composto que apresenta o grupo carbonila ligado a duas cadeias ou
radicais orgânicos.
FÓRMULA GERAL
Nomenclaturas das cetonas
A nomenclatura IUPAC
das cetonas contém a terminação ONA. A cadeia principal é a mais
longa que inclui a carbonila, e a numeração é feita a partir da extremidade mais próxima da carbonila.
A nomenclatura usual das cetonas contém a palavra cetona, seguida dos nomes dos grupos ligados à carbonila, em ordem alfabética, e com a
terminação ílica.
Exemplos:
Casos particulares com nomes próprios:
as cetonas cíclicas
Principais Cetonas
Acetona - A acetona comum ou propanona é um líquido incolor, inflamável, de cheiro agradável e solúvel em
água e em solventes orgânicos.
É usada
como solvente (de esmaltes, tintas, vernizes), na extração de óleos de sementes
vegetais, de medicamentos etc.
O grupo
CO característico dos aldeídos e cetonas, aparece também em muitos compostos
naturais, como essências, perfumes e fixadores, extraídos de vegetais e de
animais. Exemplos: Jasmona (óleo essencial de jasmim), Muscona (óleo do veado
almiscareiro)...
Jasmim Essência Veado Almiscareiro Muscona
Agora é só exercitar, vem aí os exercícios!
PELO PROFESSOR EUDO ROBSON
terça-feira, 2 de abril de 2019
ESTUDO DOS ÉTERES - QUÍMICA ORGÂNICA
ESTUDO DO ÉTERES
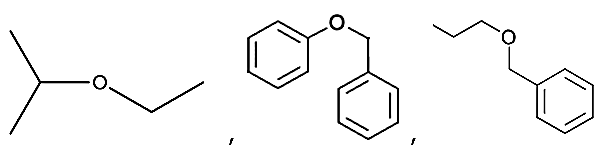
- São compostos orgânicos nos quais o oxigênio está diretamente ligado a dois grupos alquila ou arila (cadeias carbônicas). Os éteres são também denominados “óxidos orgânicos” e podem ser considerados como derivados da água (H – O - H), pela substituição dos dois hidrogênios por grupos orgânicos.
FÓRMULAS GERAIS -
R – O – R,
AR – O – R,
R – O - R’
AR – O – AR’
Exemplos:
CLASSIFICAÇÃO DOS ÉTERES
I –
Éteres Simétricos
- São aqueles que têm os radicais
iguais. (R –
O – R) ou (Ar – O – AR)
II –
Éteres Assimétricos
- São aqueles que têm os radicais diferentes.
(AR – O – R)
ou (Ar – O – AR’)
III –
Éteres Aromáticos o Mistos
- São aqueles que apresentam o anel
Benzênico ou anel aromático.
IV –
Éteres Alifáticos
- São aqueles que apresentam os
radicais não aromáticos.
Atenção: Há também éteres cíclicos, que são então compostos
heterocíclicos, nos quais o oxigênio é o heteroátomo.
Nomenclatura dos éteres
A nomenclatura IUPAC
dos éteres contém a palavra óxi intercalada nos nomes dos dois grupos formadores
do composto:
A nomenclatura usual contém a
palavra Éter seguida pelos nomes dos dois grupos, em ordem alfabética, e finalizada
com a terminação ílico.
OBS: Há
também nomes particulares.
Exemplos:
segunda-feira, 1 de abril de 2019
PROPRIEDADES COLIGATIVAS - INTRODUÇÃO
PROPRIEDADES
COLIGATIVAS
INTRODUÇÃO
Quando adicionamos um soluto não volátil a um
líquido puro, algumas propriedades desse líquido sofrem modificações tais como:
abaixamento da
pressão máxima de vapor, abaixamento da temperatura de congelação e um fenômeno
chamado pressão Osmótica.
Essas modificações ou efeitos são chamados de propriedades coligativas.
OBS: Os efeitos
coligativos dependem exclusivamente do número de partículas dispersas.
CÁLCULO DO NÚMERO DE PARTÍCULAS DISSOLVIDAS
Existem 2 tipos de cálculos: um para as
soluções iônicas, outro para as soluções moleculares. Numa solução molecular o
cálculo é feito a partir do número de moles do soluto.
Ex:
Qual o número de partículas dissolvidas numa solução aquosa contendo 34,2 gramas de sacarose
(C12H22O11)? mol = 342.
1 mol ® 6,02 x 1023
0,1 mol ® x
x = 6,02 x 1022
partículas.
Ex2:
No preparo de 200 mL de uma solução aquosa 0,4 molar, foi adicionado uma certa
massa de glicose (C6H12O6). Qual o nº de
partículas dissolvidas
1 mol
® 6,02
x 1023
0,08
® x
x
= 4,82 x 1022 moléculas.
Numa solução iônica, deve ser observado o
fenômeno da ionização, levando em conta o número de íons dissolvidos e o número
de moléculas não-ionizadas. Para isso devemos conhecer o fator VAN’T HOFF.
FATOR DE VAN’T HOFF (i)
- É o fator que depende do grau de ionização.
Lembrando que:
Chamando:
-
Serve para calcular a razão entre as partículas dispersas e as partículas
adicionadas e q = número total de íons produzidos pela
dissociação.
Temos:
Atente para o fato de:
Onde: np = n.º de partículas.
Obs.: Portanto, o fator de Van’t Hoff depende
de µ e i.
EXEMPLOS
Ex: Qual
é o fator de Van’T Hoff numa solução aquosa de HF, sabendo que µ = 80 %?
HF
® H+ + F-
1 molécula 1
cátion 1 ânion
¯
î í
1 molécula gerou 2 íons
Tomando 100 moléculas como
base de cálculo, teremos:
ou seja, 20 moléculas não ionizaram e
formaram-se 80 cátions e 80 ânions. Total das partículas 180.
Agora, para calcularmos o número de
partículas dissolvidas numa solução iônica, basta multiplicarmos o fator pelo
número de moles e pelo número de Avogadro.
Ex2:
Calcule o fator de correção do sulfato de alumínio cujo µ = 70 %.
µ = 70 %
µ = 0,7
i
= 1 + µ (q - 1)
i
= 1 + 0,7 (5 - 1)
i
= 3,8
Ex3:
Dissolvem-se 18,9 g
de H2SO4 em água. Qual o número de partículas na solução
dado µ = 82 %.
H2SO4 ® 2H+ + SO4
- 2
i = 1 + 0,82 (3 - 1)
i = 1 + 1,64
i = 2,64
PELO PROFESSOR EUDO ROBSON
ESTUDO DOS ÁLCOOIS E FENÓIS - QUÍMICA ORGÂNICA
QUÍMICA ORGÂNICA - FUNÇÕES OXIGENADAS
Definição:
- São aquelas que contêm oxigênio, além de carbono e hidrogênio.
Vamos
estudar as mais importantes, que são: álcoois, fenóis, éteres, aldeídos,
cetonas, ácidos carboxílicos e seus derivados.
I
– ESTUDO DOS ÁLCÓOIS
Definição:
- São compostos orgânicos que contêm um ou mais
grupos oxidrila ou hidroxila (OH) ligados diretamente a átomos de carbono saturados, ou seja,
carbono hibridizado na forma sp3.
FÓRMULA GERAL: R – OH
Exemplos:
ATENÇÃO!
Nem
todos os compostos que apresentam o grupo HIDROXILA (OH), podem ser
considerados álcoois.
Exemplos:
Os
álcoois são numerosos e diversificados.
Exemplos:
- Glicerina, usada em sabões, em
cosméticos, nas tintas de impressão gráfica, como aditivo em alimentos etc.;
- Açúcares, como a glicose, a sacarose etc.;
-
Amido, existente na batata, na mandioca, no trigo
etc.;
-
Celulose, presente no papel que usamos diariamente;
etc.
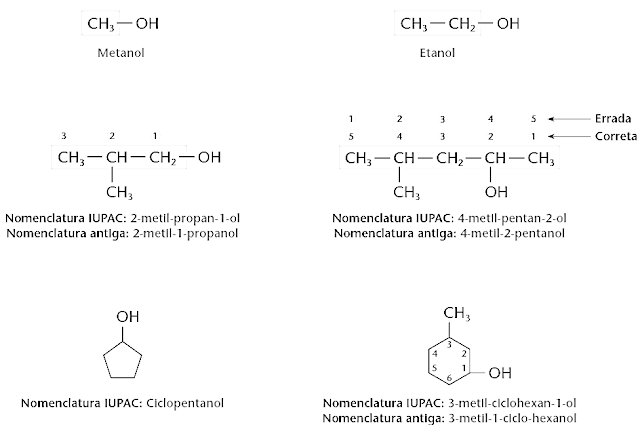
Nomenclatura IUPAC dos álcoois
A
cadeia principal recebe o nome do hidrocarboneto correspondente mais a
terminação OL.
Exemplos:
Metano
– Metanol
Etano
- Etanol
Propano
– Propanol
Butano
- Butanol
Se
houver ramificação a prioridade é dada para o grupo hidroxila. Começa-se a
contagem a partir do grupo e segue-se como de costume.
Exemplos:
Em
moléculas mais complicadas, a nomenclatura IUPAC considera a hidroxila como
sendo uma ramificação, chamada de hidróxi:
Nomenclatura
comum, muito usada, é:
Exemplos:
CLASSIFICAÇÃO DOS ÁLCOOIS
- CONSIDERANDO A CADEIA CARBÔNICA
- CONSIDERANDO O NÚMERO DE
HIDROXILAS
a) Monoálcoois ou Monóis (têm uma HIDROXILA):
CH3-CH2-CH2—CH2-OH
b) Diálcoois ou Dióis (têm duas HIDROXILAS):
HO-CH2-CH2-OH
c) Triálcoois ou Trióis (têm três HIDROXILAS):
e assim
por diante: tetróis, pentóis, polióis etc.
- DE ACORDO COM A POSIÇÃO DA
HIDROXILA
a) Álcool Primário (tem a HIDROXILA ligada a carbono primário):
CH3-CH2-CH2—CH2-OH
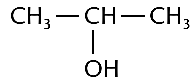
b) Álcool Secundário (tem a HIDROXILA ligada a carbono secundário):
c) Álcool Terciário (tem a HIDROXILA ligada a carbono terciário):
NÃO EXISTE ÁLCOOL QUATERNÁRIO!
Definição:
- São
compostos orgânicos com uma ou mais HIDROXILAS (OH) ligadas diretamente ao anel
aromático.
FÓRMULA GERAL: AR – OH
Exemplos:
ATENÇÃO!
Nem
todos os compostos orgânicos com grupos Hidroxilas (OH) ligados
a uma
cadeia carbônica fechada são Fenóis. Lembre-se que tem que ser aromático!
Exemplo:
Nomenclatura IUPAC dos fenóis
- A
nomenclatura IUPAC dá aos fenóis a terminação ol
ou o prefixo hidróxi. No entanto, como acontece com todos os compostos aromáticos, os
fenóis mais simples têm nomes comuns, que são aceitos pela IUPAC.
Exemplo:
- Nas moléculas mais complexas, usamos o prefixo Hidróxi. Existindo várias ramificações no anel aromático, a numeração inicia-se na Hidroxila e prossegue no
sentido que proporciona números menores.
Exemplos:
USOS:
Um desinfetante
barato, muito usado em agropecuária, é a Creolina, que é uma solução aquosa, alcalina, da mistura dos cresóis.
É fácil identificar fenóis, veja nas fórmulas estruturais abaixo:
AGORA EXERCITE PARA FIXAR O QUE FOI ESTUDADO!
PELO
PROFESSOR EUDO ROBSON
Subscrever:
Mensagens (Atom)