REVISÃO DE QUÍMICA BÁSICA - SEPARAÇÃO DE
MISTURAS - 9º E 1º ANOS (PARTE 3)
01.(UFG- 2007). Em um recipiente contendo 100 mL (1,37 kg) de mercúrio líquido, são colocados dois cubos (A e B), com volumes de 2 cm3 cada, de um material inerte diante do mercúrio. Os cubos têm massas de 14 g e 20 g, respectivamente. Ao serem colocados no recipiente,
a) os cubos vão para o fundo.
b) o cubo A afunda e o B flutua.
c) o cubo B afunda e o A flutua.
d) os cubos flutuam a meio caminho do fundo.
e) os cubos ficam na superfície do líquido.
02.(UNICENTRO-2007). Considere os seguintes fenômenos:
I. adição de álcool a gasolina.
II. fusão de uma barra de ferro.
III. solidificação da água.
IV. evaporação de éter.
V. queima da vela.
VI. explosão de dinamite.
O número de fenômenos químicos representados é
a) 2.
b) 3.
c) 4.
d) 5.
e) 6.
03. (UFPE- 2003). Em quais das passagens grifadas abaixo está ocorrendo transformação química?
1)“O reflexo da luz nas águas onduladas pelos ventos lembrava-lhe os cabelos de seu amado”.
2)“A chama da vela confundia-se com o brilho nos seus olhos”.
3)“desolado, observava o gelo derretendo em seu copo e ironicamente comparava-o ao seu coração”.
4)“Com o passar dos tempos começou a sentir-se como a velhatesoura enferrujando no fundo da gaveta”.
a) 1 e 2.
b) 2 e 3.
c) 3 e 4.
d) 2 e 4.
e) 1 e 3.
04. (UTFPR-2006). Na tabela abaixo estão apresentados os pontos de fusão e de ebulição de algumas substâncias. Qual das substâncias abaixo estariam em estados físicos diferentes em regiões de frio intenso (– 15ºC) e calor intenso (50ºC)?
a) Água, álcool etílico e fenol.
b) Água, éter etílico e pentano.
c) Água, éter etílico, etanol e fenol.
d) Água, éter etílico, fenol e pentano.
e) Todas as substâncias.
05. (UEPB- 2007). Um aluno pegou quatro recipientes contendo água em temperaturas variadas. Em seguida mergulhou uma das mãos no recipiente com água fria (5 ºC) e a outra mão no recipiente com água morna (45 ºC). Após dois minutos, retirou-as e mergulhou imediatamente em outros dois recipientes com água a temperatura ambiente (25 ºC), conforme a ilustração abaixo. Lembre-se que a temperatura do corpo humano é de aproximadamente 36 ºC. Com base no exposto, julgue as afirmações a seguir.
I. No recipiente com água fria ocorre transferência de energia na forma de frio da água fria para a mão; e no recipiente com água morna ocorre transferência de energia na forma de calor da água morna para a mão.
II. No recipiente com água fria ocorre transferência de energia na forma de calor da mão para a água fria; e no recipiente com água morna ocorre transferência de energia na forma de calor da água morna para a mão.
III. No recipiente com água fria ocorre transferência de energia na forma de trabalho da água fria para a mão; e no recipiente com água morna ocorre transferência de energia na forma de calor da água morna para a mão.
IV. No passo B (ver ilustração), a mão que sente a maior diferença de temperatura é a mão imersa na água fria. No passo C, apesar da água dos recipientes estar a uma mesma temperatura (25 ºC), a mão oriunda da água fria passa uma sensação de ser colocada em uma água morna; e a outra mão, uma sensação de água fria.
Estão corretas:
a) Apenas II, III e IV.
b) Apenas I, II e III.
c) Apenas II e IV.
d) Apenas I e IV.
e) Todas as alternativas.
06. (UFAM- 2007). Três líquidos, com suas respectivas densidades: benzeno (0,87 g/cm3), tetracloreto de carbono (1,59 g/cm3) e metanol (0,79 g/cm3), foram misturados a água pura. Destas substâncias, as duas primeiras são apolares (não solubilizam na água). Considerando a densidade normal da água pura (1,0 g/cm3), qual das afirmativas, em relação ao esquema abaixo, é verdadeira?
a) No tanque I o líquido 1 é o metanol e o líquido 4 o tetracloreto de carbono.
b) No tanque II o líquido 1 é o benzeno, a região 2 é uma fase homogênea (água+metanol) e o líquido 3 é o tetracloreto de carbono.
c) No esquema do tanque I cada região representa um dos líquidos, sendo o de cima de menor densidade e de baixo de maior densidade.
d) No tanque II o líquido 1 é o tetracloreto de carbono, a região 2 é uma fase homogênea (água+metanol) e o líquido 3 é o benzeno.
e) A região 2 do tanque 2 é bifásica homogênea, composta por água e metanol.
07. (ERSHC-2019)
Analisando o gráfico acima, podemos concluir:
a) é do aquecimento de uma solução.
b) é do aquecimento de uma suspensão.
c) é do resfriamento de uma espécie química.
d) é do resfriamento de uma mistura eutética.
e) é do resfriamento de uma mistura azeotrópica.
08. (UEPG-2006-Adaptada). Durante a preparação tradicional do cafezinho brasileiro, são utilizados alguns procedimentos de separação de misturas. Assinale o que for correto.
a) No preparo do cafezinho, além da separação de compostos insolúveis em água, são liberados compostos voláteis.
b) Utiliza-se o pó ao invés de grãos inteiros, devido ao aumento da superfície, facilitando a extração dos compostos de interesse.
c) No processo ocorrem as etapas de destilação por arraste de vapor e filtração simples.
d) No preparo do cafezinho, a seqüência de operações utilizadas é dissolução e filtração.
e) No preparo do cafezinho, utiliza-se água quente porque esta aumenta a solubilidade da mistura heterogênea.
09. (UEM-2006). Considere o fluxograma abaixo, relativo à separação dos componentes de uma mistura constituída de biodiesel e de frutose totalmente dissolvida em água.
Os processos I e II equivalem, respectivamente, a
a) filtração simples e decantação.
b) decantação e destilação.
c) filtração simples e centrifugação.
d) centrifugação e decantação.
e) sublimação e filtração simples
10. (CEFET- 2006). Aquecendo-se o leite até ficar morno e acrescentando-se vinagre, formam-se grumos de um material sólido que é a caseína, uma das proteínas do leite. Coando-se em um pano, separa-se a caseína. Continuando-se a aquecer o líquido restante até a ebulição, forma-se outro material sólido, que é outra proteína do leite, a albumina. Coando-se novamente, separa-se a albumina. Deixando-se evaporar o líquido restante, forma-se um resíduo sólido de sabor adocicado, constituído principalmente pelos açúcares e sais minerais do leite. Os processos de separação de misturas que permitiram, nesse procedimento, a obtenção da caseína, da albumina e do resíduo adocicado são, respectivamente:
a) filtração; filtração; cristalização.
b) filtração; filtração; levigação.
c) filtração; levigação; centrifugação.
d) decantação; centrifugação; destilação.
e) decantação; filtração; destilação.
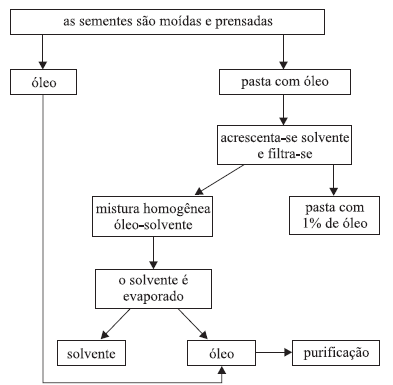
As questões de números 11 e 12 referem-se ao seguinte esquema, que mostra etapas da obtenção de óleo de soja:
11. (CEFET-SP- 2007). Examinando-se esse esquema, pode-se concluir que o solvente empregado para separar o óleo da pasta
I. pode ser a água;
II. deve ter temperatura de ebulição inferior à do óleo;
III. deve ser miscível com o óleo.
É correto o que se afirma apenas em
a) I.
b) II.
c) III.
d) I e II.
e) II e III.
12. (CEFET-SP- 2007). Entre os processos de separação de misturas indicados nesse esquema, estão a
a) extração com solvente e a centrifugação.
b) extração com solvente e a filtração.
c) filtração e a centrifugação.
d) filtração e a levigação.
e) levigação e a flotação.
13. (ERSHC-2013). Considere os aparelhos de laboratório estudados. São usados, respectivamente, usados para separação de líquidos imiscíveis e para medir e transportar volume fixo de líquidos: (As figuras não estão em sequência )
a) Bureta e Funil simples.
b) Funil simples e Pisseta.
c) Proveta e Funil de Bromo.
d) Funil de Decantação e Bureta.
e) Funil de Bromo e Pipeta volumétrica.
14.(ERSHC -2013). Quando misturamos quantidades iguais de soro fisiológico, álcool ,
acetona, areia, granito e óleo, num recipiente adequado, o sistema obtido será
formado por:
a) oito fases e dez componentes.
b) Cinco fases e seis componentes.
c) Cinco fases e nove componentes.
d) Seis fases e dez componentes.
e) Seis fases e nove componentes.
15. Qual mistura apresenta este gráfico de aquecimento?
a) azeotrópica.
b) homogênea.
c) eutética.
d) heterogênea.
e) n. r. a.
16. (FUVEST). O vapor obtido pela ebulição das seguintes soluções:
I. água e sal
II. água e açúcar
III. água e álcool
é constituído de água pura apenas:
a) no caso I.
b) no caso II.
c) no caso III.
d) nos casos I e II.
e) nos casos II e III
17. (VUNESP - Adaptada). Na preparação do café, a água quente entra em contato com o pó e é
separada o coador. As operações envolvidas nessa separação são,
respectivamente:
a) destilação e decantação.
b) filtração e destilação.
c) destilação e coação.
d) extração e filtração.
e) extração e decantação.
18. A
figura representa o esquema de um experimento para determinação do teor de
álcool na gasolina. Com base no experimento e considerando que não há variação
de volume, pode-se afirmar que o teor de álcool, em volume, na gasolina
analisada e o processo de extração utilizado são, respectivamente,
a) 11% e dissolução fracionada.
b) 22% e dissolução fracionada.
c) 11% e decantação fracionada.
d) 22% e decantação fracionada.
e) 11% e destilação fracionada.
19. Para
se realizar uma destilação simples, são necessárias as seguintes vidrarias:
a) bureta, pipeta e balão.
b) vidro de relógio, pipeta e
dessecador.
c) balão, condensador e erlenmeyer.
d) condensador, funil e béquer.
e) funil, béquer e erlenmeyer.
20.Uma
das etapas do funcionamento de um aspirador de pó utilizado nas residências
domésticas é:
a) Uma filtração.
b) Uma decantação.
c) Uma sedimentação.
d) Uma centrifugação.
e) Todas as alternativas estão
corretas.
21.Quantas
fases estão presentes no sistema: areia + sal + açúcar + água + gasolina?
a) 1.
b) 3.
c) 5.
d) 2.
e) 4.
PELO PROFESSOR EUDO ROBSON