EXERCÍCIOS
DE REAÇÕES
QUÍMICAS INORGÂNICAS
– 1º ANO
01) (UFS). Para obter iodo (I2) a partir de iodeto de
potássio dissolvido em água, basta adicionar à solução:
(A) bromo líquido.
(B) ácido clorídrico.
(C) oxigênio gasoso.
(D) dióxido de carbono gasoso.
(E) hidróxido de sódio sólido.
02) (UFS). Quando se borbulha cloro gasoso em uma solução aquosa de
soda cáustica obtém-se solução bactericida que contém, entre outros compostos:
(A) perclorato de sódio.
(B) bicarbonato de sódio.
(C) hipoclorito de sódio.
(D) ácido clorídrico.
(E) peróxido de hidrogênio.
03) (UFS). Hematita e galena são minerais dos quais se obtêm, respectivamente,
os metais:
(A) cobre e ferro.
(B) zinco e cobre.
(C) ferro e cobre.
(D) zinco e chumbo.
(E) ferro e chumbo.
04) (UFS). Pode-se
diminuir a alcalinidade de um produto adicionando-se ao mesmo:
(A) vitamina C.
(B) amônia.
(C) bicarbonato de sódio.
(D) sal de cozinha.
(E) leite de magnésia.
05) (UFS). O processo industrial para a obtenção do aço utiliza como
matérias-primas minérios de ferro e:
(A) carvão.
(B) enxofre.
(C) cobre.
(D) ácido sulfúrico.
(E) soda cáustica.
06) (UFS). Ácido
nítrico pode ser obtido em laboratório pela reação de ácido sulfúrico concentrado
com:
(A) nitrogênio do ar.
(B) amônia.
(C) salitre do Chile.
(D) hematita.
(E) calcário.
07) (UFS). Há formação de precipitado quando solução diluída de ácido
clorídrico é adicionado a uma solução que contém íons:
(A) H+(aq)
(B) Ag+(aq)
(C) Ca2+(aq)
(D) Mg2+(aq)
(E) Na+(aq)
08) (UFS). Ácido sulfúrico pode ser obtido industrialmente a partir da
oxidação do enxofre, processo este que ocorre em várias etapas. Em uma delas, a
reação que ocorre é representada por:
(A) 2S + O2 ------ 2SO
(C) S + O2 ------ SO2
(D) S+ Cl2 ------ SCl2
(E) 2S + Cl2 ------ S2Cl2
09).(VUNESP). A reação de obtenção de amônia (NH3), pelo processo Haber, a partir dos gases hidrogênio (H2) e nitrogênio (N2), pode ser classificada como
a) reação de análise com expansão de volume.
b) reação de síntese com contração de volume.
c) reação de simples troca com liberação de calor.
d) reação de dupla troca com liberação de calor.
e) reação de óxido-redução com expansão de volume.
Instruções: As questões de números 10 e 11 relacionam-se com a seguinte tabela de solubilidade de sais, em
água:
10) (UFS). Pode ser citado como sal INSOLÚVEL em água:
(A) carbonato de sódio.
(B) brometo de potássio.
(C) cloreto de amônio.
(E) nitrato de prata.
11) (UFS). Em quatro tubos de ensaio rotulados por I, II, III e IV
misturam-se soluções aquosas de:
I. brometo
de sódio + nitrato férrico.
II. iodeto de
potássio + sulfeto de amônio.
III. sulfeto
de sódio + nitrato de zinco.
IV. carbonato
de sódio + brometo de cálcio.
Há formação de um precipitado em:
(B) I e III
(C) II e III
(D) II e IV
(E) III e IV
12) (UFS). O carbonato de cálcio é a substância que está presente em
maior proporção:
(A) na bauxita.
(B) no calcário.
(C) na calcedônia
(D) na hematita.
(E) na galena.
13). A Cal viva é o óxido de cálcio. Faça a reação da cal com
a água. Porque, na agricultura, a cal é adicionada ao solo?
14). Faça a reação entre HNO3 +
Be(OH)2, dando um hidroxissal. Qual o sal obtido?
15). Escreva as equações de neutralização total correspondente
às reações entre os compostos:
a)
H2SO4 +
KOH --------------------
b)
H2MnO4 +
NaOH ---------------
c)
H2SO4 +
Ca(OH)2 -------------
d)
Al(OH)3 + H3AsO4 ------------
16).Complete
as reações abaixo, quando possível:
b)
K2O2 +
HBr -----------------
c)
NO + HCl --------------------
d)
Cl2O7 +
HBr ------------
17).(Fuvest). Podendo-se dispor, como reagentes, de BaO, Ba
(metal), SO3 e de soluções aquosas de H2SO4,
HCl, Ba(OH)2 e BaCl2, equacione 4 reações que permitam obter sulfato de bário.Escreva os
nomes dos compostos envolvidos nos métodos de obtenção escolhidos.
18).
(FAAP-SP). Escreva as equações químicas
de duas reações que caracterizam o SO3 como óxido ácido.
19.
(Fatec-SP). Considerando as reações, em
solução aquosa:
I. Na2S + 2HCl ---------- 2NaCl + H2S
II. 3Na2S + 2FeCl3 ---------- 6NaCl + Fe2S3
Pode-se deduzir que:
a)
Ambas se realizam, na prática,
devido à formação de um precipitado.
b)
Ambas se realizam, na prática,
devido à formação de um eletrólito fraco.
c)
A I se realiza, na prática,
devido à formação de um precipitado.
d)
A II se realiza, na prática,
devido à formação de um precipitado.
e)
Ambas não se realizam, na
prática.
20. (FUVEST-SP). Escreva a equação da reação entre KOH e H3PO4,
presentes na proporção 1 para 1, e dê o nome do sal formado.
21.
(Fuvest-SP). A respiração de um astronauta
numa nave espacial causa o aumento da concentração de dióxido de carbono na cabine. O dióxido de carbono é continuamente
eliminado através de reação química com reagente apropriado. Qual dos reagentes
abaixo é o mais indicado para retirar o dióxido de carbono na atmosfera da
cabine?
a)
Ácido sulfúrico concentrado.
b)
Hidróxido de lítio.
c)
Ácido acético concentrado.
d)
Água destilada.
e)
Fenol.
22. (Fuvest-SP). A: na forma sólida é conhecido como gelo-seco e é
considerado o principal responsável pelo efeito estufa. B: apresenta cor castanho-avermelhado e tem
importância na destruição da camada estratosférica de ozônio. C: apresenta odor de ovo e enegrece objetos
de prata.
As características A, B e C
correspondem respectivamente aos gases:
a)
CO2, H2S
e NO2
b)
CO2, NO2
e H2S
c)
NO2, CO2
e H2S
d)
NO2, H2S
e CO2
e)
H2S, CO2
e NO2
23. (Fuvest-SP). Uma certa massa de CaCO3, úmida, colocada
em um cadinho inerte e estável à temperatura, foi submetida a um aquecimento
contínuo e uniforme em um forno aberto.
O gráfico da variação da massa total do cadinho em função da temperatura
do forno apresentou o aspecto abaixo:
a)
Que processo ocorreram nos
trechos AB e CD?
b)
Que substância restou no
cadinho na situação correspondente ao ponto E?
Dê uma característica química da mesma.
24. (FUVEST-SP). Holanda quer deixar
de ser um País Baixo Cientistas estão pesquisando a viabilidade de se elevar o
litoral holandês — que é muito baixo e há séculos vem sendo ameaçado por
enchentes — por meio da injeção de substâncias químicas na terra. Os
pesquisadores acreditam em poder elevar o litoral injetando ácido sulfúrico
numa camada de rocha calcária 1,5 km abaixo da superfície. A reação química
resultante produziria gipsita, que ocupa o dobro do espaço do calcário e que
empurraria a superfície terrestre para cima. Folha de S. Paulo Sabendo que a
gipsita é CaSO4 hidratado e que o calcário é CaCO3, a
reação citada produz também:
a) H2S
b) CO2
c) CH4
d) SO3
e) NH3
25.(FUVEST-SP). Considere soluções
aquosas de: nitrato de sódio (NaNO3), nitrato de chumbo (Pb(NO3)2)
e cloreto de potássio (KCl). Misturando-se essas soluções duas a duas, obtêm-se
os seguintes resultados: NaNO3 + Pb(NO3)2 → não
há precipitação NaNO3 +
KCl → não
há precipitação Pb(NO3)2
+ KCl → forma-se precipitação
a) Escreva a equação
da reação de precipitação.
b) Qual substância constitui o
precipitado?
Justifique sua resposta, baseando-se nas
informações acima.
26. (Fuvest-SP). A chuva ácida (com H2SO4) pode transformar o
mármore (CaCO3) das estátuas em gesso (CaSO4). Escreva a equação que representa essa
transformação.
27. (ITA-SP). Um pedaço de magnésio é jogado em solução diluída de ácido clorídrico;
observa-se a dissolução do metal e o desprendimento de um gás. O gás que se desprende é:
a) Hidrogênio
b) Cloro
c) HCl
d) Cloreto de magnésio
e) Oxigênio.
28. (Unicamp-SP). Antiácido é um produto farmacêutico utilizado para
reduzir aacidez estomacal provocada pelo excesso de acido clorídrico, HCl. Este
produto farmacêutico pode ser preparado à base de bicarbonato de sódio, NaHCO3. Escreva
a reação do bicarbonato com ácido clorídrico.
29). (ERSHC-1998). Para que uma
reação química ocorra são necessários certos pré-requisitos. Sobre eles, julgue
as sentenças:
V
|
F
|
|
0
|
0
|
Para haver uma reação, é
necessário o melhor contato possível.
|
1
|
1
|
Para haver uma reação,
basta o menor contato entre os reagentes.
|
2
|
2
|
Para haver uma reação,
basta haver afinidade entre os reagentes.
|
3
|
3
|
Para haver uma reação, tem
que haver mais do que afinidade entre os reagentes.
|
4
|
4
|
Se for entre dois sais os
reagentes têm que ser solúveis e pelo menos um dos produtos tem que ser
insolúvel.
|
30). (ERSHC-1998). Sobre os tipos de reação e suas características,
julgue as sentenças:
V
|
F
|
|
0
|
0
|
Pirólise é a decomposição
pelo calor.
|
1
|
1
|
Calcinação e pirólise
significam a mesma coisa.
|
2
|
2
|
Fotólise é a decomposição
pela fotografia.
|
3
|
3
|
Eletrólise é a
decomposição pela energia solar.
|
4
|
4
|
A mudança de coloração
caracteriza uma reação química.
|
31). (PUC-RS). O produto gasoso obtido no tubo de ensaio (veja o
esquema) pode ser identificado pelo emprego de:
a)
Identificador de fenolftaleína
b)
Palito em brasa
c)
Papel de tornassol vermelho
d)
Solução de amido
e)
Água de cal
32).
(Mack-SP-2005)
Analisando
a fila de eletropositividade em ordem decrescente, verifica-se que a única
reação que não ocorre é:
a)
Hg
+ Al (NO3)3
b)
Fe
+ H2SO4
c)
Cu
+ AgNO3
d)
Mg
+ FeSO4
e)
Zn
+ HCl
33).
(UFPEL-2006).
COVRE, Geraldo José. Química: o homem e a natureza. São Paulo: FTD, 2000.
A reação química balanceada que NÃO ocorre espontaneamente,
de acordo com as séries de reatividade acima, é
a) Br2(ℓ) + NaCℓ(s) --------- 2 NaBr(aq) + Cℓ2(g).
b) Mg(s) +2 AgNO3(aq) --------- Mg(NO3)2(aq) + 2 Ag(s).
c) Zn(s) + 2 HCℓ (aq) ---------- ZnCℓ2(aq) + H2(g).
d) Br2(ℓ) + 2 NaI (aq) ---------- 2 NaBr(aq) + I2(s).
e) Zn(s) + CuSO4(aq) ---------- ZnSO4(aq) + Cu(s).
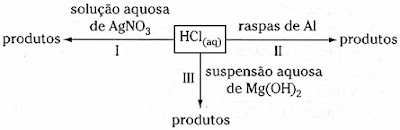
34. (Fuvest-SP). Ácido clorídrico pode reagir com
diversos materiais formando diferentes produtos, como mostrado no esquema
abaixo:
Os seguintes sinais
evidentes de transformações químicas: liberação de gás, desaparecimento parcial
ou total de sólido e formação de sólido são observáveis, respectivamente, em:
a) I, II e III
b) II, I e III
c) II, III e I
d) III, I e II
e) III, II e I
Pelo Prf. Eudo Robson
GABARITO
1- A
2- C
3- E
4- A
5- A
6- B
7- B
8- C
9- B
10- D
11- E
12- B
13- Cao +
H2O ----- Ca(OH)2 , por que ele neutraliza a acidez do solo.
14- BeOHNO3 + H2O
15- K2SO4 + H2O
, Na2MnO4 + H2O , CaSO4 + H2O , AlAsO4 + H2O
16-
17-
18-
19- D
20- KOH + H3PO4 -------
KH2PO4 + H2O , Dihidrogenofosfato de potássio.
21- B
22- B
23-
24- B
25- Pb(NO3)2 + KCl → PbCl + KNO3 , É o Cloreto de Chumbo II, popis os cloretos são insolúveis com os íons Ag, Pb, e Hg.
26- H2SO4
+ CaCO3 -------- CaSO4 + H2CO3
27- A
28- HCl + NaHCO3 ------
NaCl + H2O + CO2
29- VFFVV
30- VVFFV
31- B
32- A
33- A
34- C






Sem comentários:
Enviar um comentário