REVISÃO PARA O ENEM
01 - Em muitos foguetes, utiliza‑se a reação entre a hidrazina (N2H4) e o tetróxido de dinitrogênio (N2O4).
2 N2H4 (l) + N2O4 (l) ® 3 N2 (g} + 4H2O (g)
Durante essa reação, a expansão dos gases produzidos fornece a energia mecânica necessária para que o foguete se movimente e consiga escapar da gravidade da terra.
Com relação ao enunciado descrito, julgue os itens a seguir:
0 0
1 1
2 2
3 3
|
O N2O4 sofre redução e é, portanto, o oxidante.
O estado de oxidação do N2 é igual a ‑3.
A ligação entre os átomos no tetróxido de dinitrogênio ocorre com
transferência de elétrons.
O oxigênio apresenta variação do seu estado de oxidação.
|
02). (AMAN-RJ. Assinale a afirmação errada. O número de oxidação do:
a) no HNO3 é + 5.
b) P no H3PO3 é + 3.
c) Mn no MnO4– é + 7.
d) Cl no ClO4– é + 7.
e) COOH o C é +4.
03). (ERSHC-1998). Sobre a reação, são feitas as afirmações abaixo.
2KMnO4 + 5H2O2 + 3H2SO4 ® K2SO4 + 2MnSO4 + 8H2O +SO2
Classifique-as:
V
|
F
| |
0
|
0
|
O elemento que se oxida é o manganês, e seu nox varia de + 7 para + 2.
|
1
|
1
|
O elemento que se oxida é potássio, e seu nox varia de + 1 para + 2.
|
2
|
2
|
O elemento que se oxida é o oxigênio, e seu nox varia de - 1 para + 2.
|
3
|
3
|
A substância oxidante é o ácido sulfúrico.
|
4
|
4
|
A substância que se oxida é a água oxigenada.
|
04). (ESPCEX -2002). Com base na informação a seguir, responda a questão.
O chumbo é um metal de transição pertencente ao grupo 4ª, podendo, quando forma compostos, apresentar dois números de oxidação (nox).
Considere a equação abaixo, que representa a reação ocorrida no interior dos acumuladores:
Pb + PbO2 + 2H2SO4 ------------ 2PbSO4 + 2H2O
O chumbo, nas substâncias, Pb, PBO2 e PbSO4, apresenta nox, respectivamente, iguais a:
a) 0, – 4 e 2
b) 0, 4 e 4
c) – 4, – 4 e 2
d) 2, 2 e 2
e) 0, 4 e 2
05). (ERHSC-2005). Observe a reação:
As2S3 + HNO3 + H2O ----------- H2SO4 + H3AsO4 + NO
Analisando o que nela ocorreu, julgue as afirmativas.
V F
| |
0 0
|
O número de elétrons cedidos na reação é 10.
|
1 1
|
O As2S3 é o agente redutor.
|
2 2
|
O HNO3 se reduz.
|
3 3
|
O HNO3 é o agente oxidante.
|
4 4
|
O enxofre se oxida, portanto, é o agente oxidante.
|
06). (UFBA). Considerando a reação a seguir:
C2H4 + KMnO4 + H2O → C2H4(OH)2 + MnO2 + KOH
I - C2H4 é o agente oxidante.
II - As ligações da água são covalentes e sua molécula é polar.
III - O Mn tem números de oxidação iguais a + 7 e + 4, respectivamente, em KMnO4 e MnO2.
IV - C2H4(OH)2 é um composto orgânico saturado (possui apenas ligações simples).
V - O número total de elétrons recebido pelo redutor é igual ao número total de elétrons cedido pelo oxidante.
Assinale a alternativa que corresponde a verdade.
a) Apenas as afirmativas I e II são corretas.
b) Apenas as afirmativas II e IV são corretas.
c) Apenas as afirmativas I, II e V são corretas.
d) Apenas as afirmativas II, III e IV são corretas.
e) Apenas as afirmativas I, III, IV e V são corretas.
07). O ácido láctico é representado pela fórmula :
A soma dos nox dos átomos de carbono nessa molécula é igual a:
a) – 2
b) – 1
c) 0
d) + 1
e) + 2
Para as questões de 08 a 09, assinale as proposições corretas, somando em seguida os números a elas associados.
08) Com base nos dados acima, identifique as afirmativas verdadeiras
V
|
F
| |
0
|
0
|
O ácido de Lewis pode aceitar um par de elétrons
|
1
|
1
|
O ácido de Arrhenius pode aceitar um par de elétrons.
|
2
|
2
|
A base de Bronsted-Lowry é um receptor de próton (H+)
|
3
|
3
|
A base de Arrhenius produz hidroxilas em solução aquosa
|
4
|
4
|
A reação Cu+2 + 4NH3 ------- [Cu(NH3)4]+2 é uma reação de neutralização, de acordo com as teorias de Bronsted-Lowry e de Lewis.
|
10).(UFBA).
I. H2O + HClO4 ---------- H3O+ + ClO-4
II. AlF3 + F- -------- AlF-4
III. 2NH3(l) ---------- NH+4(amônio) + NH-2(amônia)
V. H3PO4 + Ca(OH)2 ----------- CaHPO4 + 2H2O
Considerando-se as reações acima, pode-se afirmar:
11). (UFBA). Com relação às reações:
I. H2O + HClO4 ---------- H3O+ + ClO-4
III. NH3 + H+ --------- NH+4
V. HCl + NH3 ---------- NH+4 + Cl-
Pode-se afirmar que:
12) (ERSHC - 2008) Sobre a pilha comum , chamada de pilha seca ou pilha de Leclanché representada abaixo , julgue as sentenças:
0.0 – A barra de grafite é o pólo positivo.
1.1 - A pasta externa é composta de ZnCl2 + NH4Cl + H2O + amido.
2.2 – O fundo de aço é o ânodo e nele ocorre a reação; Zn ----- Zn+2 + 2e-
3.3 - No pólo positivo ocorre a reação : 2 MnO2 + H2O + 2e- ----- Mn2O3 +2OH-
4.4 - O recipiente de zinco é o pólo positivo.
13) (ERSHC - 2008) Observe o esquema:
Com base nele e nos conceitos de solubilidade julgue os itens:
0.0 - A dissolução e dissociação do sólida é : FeS ------- Fe+2( aq ) + S-2 ( aq ) .
1.1 – No início a velocidade de precipitação é maior do que a velocidade de dissolução.
2.2 - O equilíbrio mencionado acima é do tipo heterogêneo onde a lei da ação das massas deve
ser aplicada a fase aquosa , sendo assim teremos :
3.3 – Nesse instante a solução torna-se insaturada no qual é atingido o equilíbrio da dissolução , conforme a equação :
4.4 - Enquanto existir corpo de fundo a concentração de sulfato ferroso é constante pois se trata de uma solução saturada onde:
KPS = [ Fé+2 ] . [ S-2 ]
14) (ERSHC - 2008) Veja os esquemas sobre as baterias.
Com base nos esquemas , e em seu conhecimentos sobre baterias julgue os itens:
0.0 – O acumulador ou bateria de pilhas ligadas em paralelo, formada por 6 compartimentos gerando 12 volts.
1.1 - O cátodo é formado pelo dióxido de chumbo e o ânodo pelo chumbo metálico.
2.2 – A reação global de uma pilha pode ser :
Pb + PbO2 + HNO3 ----- 2 Pb(NO3)2 + 2 H2O
3.3- Cada compartimento da pilha produz uma força eletromotriz de 2 volts.
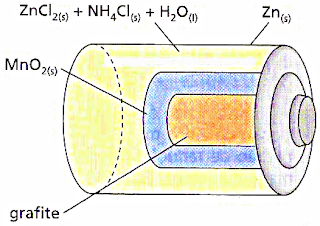
15) ( UnB – DF ) As pilhas vendidas no comércio pa -ra uso em aparelhos
elétricos, é basicamente uma cápsula de zinco, uma solução aquosa de elétrólitos
(ZnCl2 + NH4Cl ), MnO2 e um bastão de grafita. A figura abaixo representa um
corte longitudinal de uma pilha de Manganês.
Durante o funcionamento dessa pilha , ocorrem as seguintes reações:
no ânodo : Zn(S) ----- Zn +2 (aq ) + 2 e-
no cátodo : 2 MnO2 (S) + 2 NH4+(aq) + 2e- ----- Mn2O3 (S) + 2NH3(aq)
+ H2O(L)
Julgue os itens que se seguem :
0.0 – Mn+4 é o agente redutor.
1 .1 – Durante o funcionamento dessa pilha , o fluxo de elétrons ocorre no
sentido grafita ------- zinco.
2.2 - A reação total da pilha é :
Zn(S) + Mn2O3(S) + 2NH3(aq) + H2O ---- Zn+2(aq) + 2MnO2(s)
+ 2NH4+ + 4e-
3.3 - A quantidade de Zn+2 diminui durante o funcionamento da pilha
4.4 – A pilha cessará seu funcionamento quando o MnO2 for totalmente
consumido.
Pelo Prof. Eudo Robson
01 - VFFF
02 - E
03 - FFFVF
04 - E
05 - VFVVF
06 - D
07 - C
08 - VVVVF
09 - VFFFFFF
10 - VFFVFF
11 - FFVFVFF
12 - VVVFF
13 – FFVFV
14 - FVFVV
15 - FFFVV
|








Sem comentários:
Enviar um comentário