- Ocorrem quando se adiciona um reagente a uma molécula orgânica insaturada. Esta molécula pode conter uma dupla ou uma tripla ligação.
Os casos mais comuns são as adições às ligações C = C, C Ξ C e C = O.
Exemplo:
As adições à ligação dupla são as reações mais características dos alcenos. O que explica este tipo de ligação é a presença de elétrons pí. Estes formam ligações Pí que são extremamente fracas.
I – HIDROGENAÇÃO DE ALCENOS
- Ocorre com a adição de átomos de hidrogênio aos carbonos da ligação dupla, na presença de um catalisador, (Ni), (Pt) ou (Pd) em pó. O produto sempre é um ALCANO
Chamada de reação de Sabatier-Senderens, usad na produção, de margarinas a partir de óleos vegetais. Reação que ocorre sob aquecimento.
Exemplo 1:
Exemplo 2:
II –HALOGENAÇÃO DE ALCENOS
- Ocorre com a adição de um halogênio (F2, Cl2, Br2 ou I2) a um alceno, em que os halogênios rompem a ligação dupla e forma-se um dialeto vicinal, isto é, os dois átomos do halogênio ligam-se a carbonos vizinhos.
Exemplo 1:
(Não falamos no F2, pois sua alta reatividade provoca, em geral, a destruição do composto orgânico.)
III – ADIÇÃO DE HALETOS DE HIDROGÊNIO.
- Ocorre quando ácidos INORGÃNICOS (H-X, onde X= halogênio) atacam um alceno. Nesse caso, o hidrogênio e o halogênio são adicionados às ligações duplas dos alcenos. O produto final é sempre um HALETO DE ALQUILA. A ordem de reatividade deve ser observada: HI > HBr > HCl, (capacidade para doar prótons).
Se o alceno for assimétrico, segue-se a REGRA DE MARKOVNIKOV.
Esta regra determina que, o átomo de hidrogênio do HX deve ser adicionado ao átomo de carbono da dupla que tiver a maior quantidade de hidrogênios ligados a ele.
MECANISMO:
Obs: porém podem acontecer reações que não obedecem à regra de Markovnicov, mas existe uma condição. O normal é sempre obedecer.
IV - REAÇÕES DE HIDRATAÇÃO
(ADIÇÃO DE ÁGUA)
Exemplo 1:(ADIÇÃO DE ÁGUA)
Esta reação se dá em meio ácido, tendo como produto final um Álcool.
MECANISMO:
- O H+ do ácido ataca os elétrons pí da dupla ligação deixando o carbono secundário protonado, e se encaixa no carbono mais hidrogenado da dupla (Markovnicov).
- O carbono secundário, agora, protonado atrai o oxigênio da água.
- Na água, os elétrons da ligação covalente polar, são atraídos pelo oxigênio que é mais eletronegativo, formando o íon hidroxila (-).
- Agora, o íon hidroxila é atraído pelo carbono protonado entrando na molécula formando a molécula do álcool, e o hidrogênio se desloca para começar outra reação.
Exemplo 2:
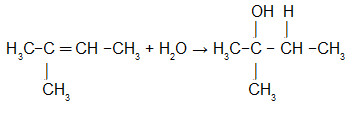
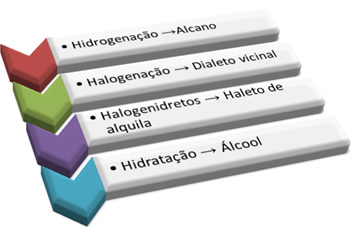
EM RESUMO TEMOS:
FONTE: http://mundoeducacao.bol.uol.com.br/
Pelo Professor Eudo Robson










Sem comentários:
Enviar um comentário