-
Isomeria espacial (ou
estereoisomeria) é aquela que somente pode ser explicada por meio
de fórmulas estruturais espaciais.
Em
outras palavras, isso significa que só iremos “enxergar” a diferença existente
entre dois isômeros espaciais se fizermos uso de modelos moleculares espaciais.
A
isomeria espacial divide-se em:
•
isomeria cis-trans (ou geométrica);
•
isomeria óptica.
Pode
ocorrer em dois casos principais, a saber:
• em
compostos com duplas ligações;
• em
compostos cíclicos.
Seja o
composto ClCH= CHCl. Usando-se o modelo de bolas, podemos ter as
seguintes arrumações espaciais:
Repare
na seguinte diferença:
• na
foto da esquerda, os dois átomos de cloro estão do mesmo lado do plano que
divide a molécula ao meio; essa é a chamada forma cis (do latim cis, aquém de);
• na
foto da direita, os dois átomos de cloro estão em lados opostos do plano que
divide a molécula ao meio; essa é a chamada forma trans (do latim trans, para além de).
Os dois
compostos dados também podem ser representados abreviadamente do seguinte modo:
Em
decorrência de suas diferentes estruturas, os isômeros cis e trans têm
propriedades físicas (densidade, ponto de fusão, ponto de ebulição etc.) e
propriedades químicas diferentes.
Exemplos
interessantes são os dos ácidos maléico e fumárico:
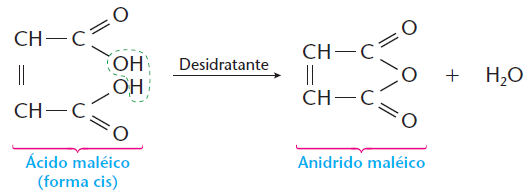
• o
ácido maléico forma anidrido com facilidade, segundo a equação:
• o
ácido fumárico, por sua vez, não forma anidrido, pois suas carboxilas estão em lados “opostos”da
molécula:
Além
disso, podemos observar as diferenças nas propriedades físicas:
Generalizando,
podemos dizer que ocorre isomeria cis-trans em compostos contendo ligação dupla
que apresentam a estrutura:
Note
que R1 (assim como R2) pode ser igual ou diferente de R3 e R4.
Os
compostos cíclicos apresentam um anel ou núcleo que é um polígono plano ou reverso.
Conforme
as ramificações (ou os substituintes) estejam acima
ou abaixo
desse polígono, podem surgir casos de isomeria
cis-trans (aqui também chamada isomeria baeyeriana, como homenagem ao cientista
Adolf von Baeyer).
Seja,
por exemplo, o composto 1,2-dicloro-ciclo-propano.
Ele
poderá apresentar as seguintes estruturas:
Na foto
da esquerda, os dois átomos de cloro estão acima do plano do anel; na foto da direita, um
átomo de cloro está
acima e o outro está abaixo do plano do anel. As duas estruturas não podem ser superpostas, de modo que temos dois isômeros
diferentes — o primeiro é o cis, e o segundo,
o trans.
Fonte dos textos e imagens: Livro Digital de Ricardo Feltre (Vol.3) Editora Moderna








Sem comentários:
Enviar um comentário