- Inicialmente, vamos
expor alguns conceitos e aspectos indispensáveis ao entendimento da isomeria
óptica.
I – LUZ NATURAL E LUZ
POLARIZADA
A luz comum (ou natural) é formada por ondas eletromagnéticas, sendo que as
ondas elétricas vibram em um plano e as magnéticas, em outro, perpendiculares
entre si.
Além
disso, à medida que a luz “caminha”, esses dois planos giram em torno de seu
próprio eixo de propagação, de modo que, vendo a luz “de frente”, se pudéssemos
enxergar essas vibrações, iríamos ver algo parecido com a figura A.
Pelo
contrário, na luz polarizada, os planos de
vibração elétrico e magnético não giram, de maneira
que, “vendo-a de frente”, teríamos a figura
B.
É comum
representar a luz polarizada apenas por um dos planos figura C.
A
maneira mais simples é usar o material denominado “polaróide” ou polarímetro,
no qual existem cristais de substâncias orgânicas complexas depositados sobre
material plástico transparente. Por estarem convenientemente orientados, esses
cristais polarizam a luz. Os polaróides ou polarímetros são usados em óculos de
sol, câmeras fotográficas etc.
No
entanto, em trabalhos científicos que requerem maior precisão, costuma-se usar
certas substâncias cristalinas, como, por exemplo, o espato da Islândia, que é uma
variedade especial e transparente de CaCO3.
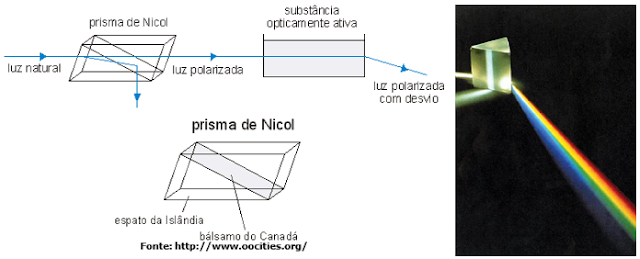
II – PRISMA DE NICOL
Com o
espato da Islândia são produzidos prismas especiais denominados prismas de Nicol, que são
usados na construção dos polarímetros (dispositivos utilizados para medir a atividade óptica da substância
em análise), como mostramos na figura seguinte.
No polarímetro
existem:
• a fonte de luz (I),
normalmente de luz monocromática (por exemplo, uma lâmpada de sódio, que produz
luz amarela);
• o polarizador (II), um
prisma de Nicol que polariza a luz;
• o tubo com a amostra (III), onde
fica a solução da substância a ser analisada;
• o analisador
(IV), um segundo prisma de Nicol, utilizado
para medir a rotação (desvio) que o plano da luz polarizada sofre quando essa
luz atravessa a substância em análise.
A luz
polarizada foi descoberta em 1808 por Malus. Logo depois, Biot descobriu que certos cristais de quartzo desviam,
ou melhor, fazem girar o plano de polarização da luz. Essas substâncias são
chamadas substâncias
opticamente ativas, ou seja, têm atividade óptica. É esse o fato que se pode observar colocando-se a substância
opticamente ativa na posição III do polarímetro que descrevemos. Posteriormente,
outros estudos comprovaram a existência de dois tipos de cristal de quartzo,
com formas geométricas assimétricas, de tal maneira que a
forma de um deles é igual à imagem do outro num espelho plano (observe na figura abaixo).
Para
entendermos melhor a assimetria existente entre os cristais de quartzo, é
interessante comparar esses cristais com pares de objetos assimétricos que possuam
formas geométricas “opostas”, tais como as nossas mãos, um par de sapatos, um
par de luvas etc. Esses objetos não
são superponíveis, isto é: colocando a mão direita sobre a mão
esquerda, elas não coincidem; a luva da mão esquerda não se ajusta à mão direita
(e vice-versa); do mesmo modo, os pares de sapatos obedecem à assimetria própria
de nossos pés; e assim por diante.
Esse
tipo de assimetria é chamado de assimetria Quiral, palavra que vem do grego Cheir. Uma descoberta importantíssima para a ciência foi a seguinte: enquanto um dos tipos de cristal de quartzo desvia a luz
polarizada para a direita, o outro a
desvia para a esquerda, com ângulos
exatamente iguais.
Surgiram
da percepção desse fato as expressões antípodas ópticos ou enantiomorfos. A substância que desvia o plano da luz polarizada para a direita chama-se
dextrogira; a que desvia para a esquerda chama-se substância levogira.
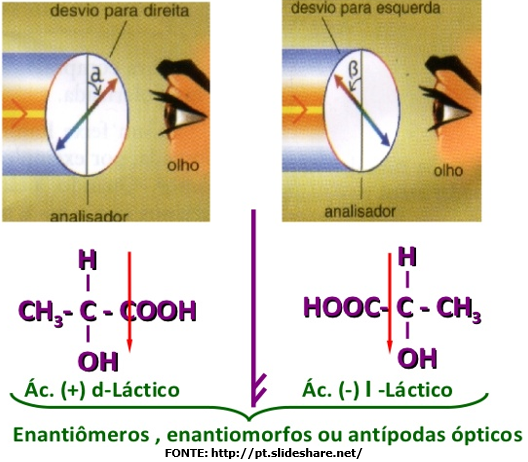
Compostos com um carbono assimétrico
O
exemplo clássico é o ácido lático (ou ácido α-hidróxi-propanóico ou
ácido-2-hidróxi-propanóico), que é proveniente do leite:
O
carbono central é assimétrico (costuma-se indicar os carbonos assimétricos com um asterisco), pois
a ele estão ligados quatro radicais diferentes: H, CH3, OH e COOH.
Lembrando a estrutura tetraédrica do carbono, temos:
Você
poderá perceber que, se tentarmos “encaixar” uma molécula na outra, nunca
haverá coincidência de todos os grupos. São, pois, moléculas diferentes (para
visualizar melhor esse fato, o leitor poderá “montar” os modelos usando
bolinhas de isopor coloridas espetadas em palitos de fósforos):
• das
duas moléculas ao lado, uma representa o ácido
lático dextrogiro, e nós escrevemos ácido d-lático ou ácido (+) lático;
• a
outra é o ácido lático levogiro, e nós escrevemos ácido l-lático ou ácido (-) lático.
Os dois
ácidos láticos têm todas as propriedades físicas iguais,
exceto o desvio do plano da luz polarizada.
Mistura Racêmica é a mistura
do isômero dextrogiro com seu antípoda levogiro, na proporção de 50% de cada um. O racêmico não desvia o plano da luz
polarizada, pois o desvio provocado por uma molécula é
sempre neutralizado pelo desvio provocado por outra.
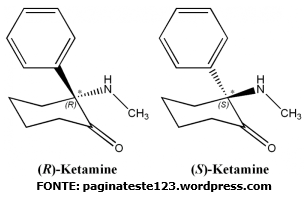
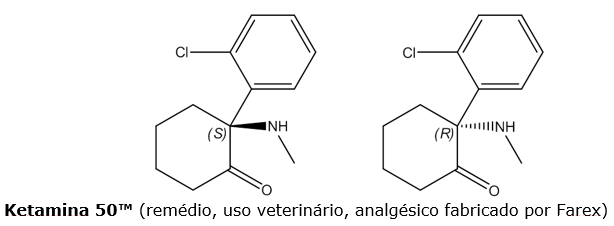
A Cetamina é uma molécula Quiral, que
apresenta um centro estereogénico em C2. A molécula possui duas formas
enantiómericas – (R) e (S), conforme a configuração do centro estereogénico.
Estes dois enantiómeros possuem actividades biológicas diferentes, sendo a
cetamina comercial uma mistura racémica, contendo partes iguais de S-Cetamina e de R-Cetamina.
Dizemos
então que o racêmico não tem atividade óptica, ou que é opticamente inativo; o racêmico é inativo por
compensação externa, já que o efeito produzido por uma molécula é
compensado externamente, por outra molécula.
O Racêmico
tem propriedades físicas diferentes das dos enantiomorfos.
O ácido
lático racêmico, por exemplo, tem ponto de fusão igual a 16,8 °C, enquanto os enantiomorfos, como vimos na tabela, têm ponto de
fusão igual a 52,8 °C.
PELO PROFESSOR EUDO ROBSON
FONTE DOS TEXTOS:
Livro digital de Ricardo Feltre VOL.3 - ED. MODERNA
qnint.sbq.org.br/
paginateste123.wordpress.com
















Sem comentários:
Enviar um comentário