SOLUBILIDADE
01 - (FATEC SP- Adaptada) Compostos de cobre (II), entre eles o CuSO4, são empregados no tratamento de águas de piscinas como algicidas. Recomenda-se que a concentração de CuSO4 não ultrapasse o valor de 1 mg/L nessas águas.
Sendo assim, considerando uma piscina de formato retangular que tenha 10 m de comprimento, 5 m de largura e 2 m de profundidade, quando cheia de água,a massa máxima de sulfato de cobre que poderá se dissolver é, em gramas, igual a
a)100.
b)200.
c)300.
d)400.
e)500.
02 - (FATEC SP- Adaptada) O fosfato de oseltamivir é recomendado no tratamento e na profilaxia de gripe em crianças e adultos, inclusive da influenza A (H1N1), sendo que o tratamento deve ser iniciado nas primeiras 48 horas, após o aparecimento dos primeiros sintomas.
Um produto com oseltamivir, encontrado nas farmácias, está disponível em cápsulas ou em pó para suspensão o qual, após ser reconstituído em água, ficará na razão de 12 mg/mL. O pó para suspensão oral é indicado para o tratamento e para a profilaxia de gripe em crianças entre 1 e 12 anos de idade, pelo fato de elas terem dificuldade de ingerir cápsulas.
Admita que as doses recomendadas para o tratamento da influenza A (H1N1) são:
• Adultos e adolescentes com 13 anos ou mais: 75 miligramas (mg), duas vezes ao dia por cinco dias.
• Crianças de 1 a 12 anos: dose ajustada pelo peso na razão de 1 mg/kg, duas vezes ao dia por cinco dias.
Se uma criança de 12 anos e 60 kg, precisar fazer o tratamento para a gripe influenza A, conclui-se que o volume total de suspensão oral que essa criança deverá ingerir, em todo o tratamento, em mililitros, é
a)10.
b)20.
c)25.
d)50.
e)65.
03 - (FPS PE/2014- Adaptada) O carbonato de sódio, Na2CO3, é um composto sólido, de cor branca, também conhecido como soda ou barrilha que pode ser utilizado na produção de vidro, na fabricação de sabões, detergentes, corantes, papéis, etc.
Se 21,2 g de Na2CO3 forem dissolvidos em água suficiente para dar 1000 mL de solução, quais serão as concentrações, em mol L–1, de Na2CO3 e dos íons sódio e carbonato em solução, respectivamente?
a)0,20; 0,40; 0,20
b)0,40; 0,20; 0,20
c)0,25; 0,125; 0,125
d)0,25; 0,25; 0,25
e)0,35; 0,35; 0,175
04 - (UNIRG TO/2014) A Lei n. 11.705, do Código de Trânsito Brasileiro, conhecida como lei seca, institui que a quantidade máxima permitida de álcool no sangue de um indivíduo é igual a 0,2 g por litro de sangue. Considerando-se este álcool como o etanol, conclui-se que a concentração, em mol/L, de etanol no sangue é aproximadamente igual a:
a)2,0 x 10–3
b)3,3 x 10–3
c)4,3 x 10–3
d)6,2 x 10–3
05 - (Univag MT/2014- Adaptada) Devido à sua propriedade germicida, o permanganato de potássio (KMnO4) pode ser empregado no tratamento de feridas.
A massa necessária desse germicida para preparar 2,5 L de solução 0,02 mol/L é, em gramas, igual a
a)1,3.
b)9,2.
c)22,4.
d)39,5.
e)7,9.
06 - (UNIRG TO/2013) Um químico preparou 200 mL de uma solução de glicose (180 g/mol) na concentração de 0,500 mol/L. Baseando-se nestas informações, conclui-se que a quantidade de matéria, em mol, de glicose presente na solução é de:
a)10
b)1
c)0,1
d)0,01
07 - (FMJ SP/2013- Adaptada) A N-acetilcisteína, massa molar = 163 g/mol, é indicada para o tratamento de pacientes com dificuldade de expectorar e que apresentam secreção densa.
Um envelope contendo 0,2 g desse medicamento foi dissolvido em 200 mL de H2O. A concentração dessa solução, em mol/L, é
a)2 x 10–2.
b)6 x 10–2.
c)1 x 10–2.
d)2 x 10–3.
e)6 x 10–3.
08 - (UNIRG TO/2012) Um estudante de química durante uma aula experimental preparou 1 litro de NaOH a 2,00 mol/L. No entanto, ele deixou a solução pronta próximo da janela e exposta ao sol. Após algum tempo ele observou que o volume tinha reduzido para ¼ do volume inicial. Determine para este estudante a concentração da solução resultante da evaporação do solvente.
a)0,25 mol /L.
b)0,50 mol /L.
c)4,00 mol /L.
d)8,00 mol /L.
09 - (UDESC SC/2013) A figura abaixo representa a curva de solubilidade de alguns sais.
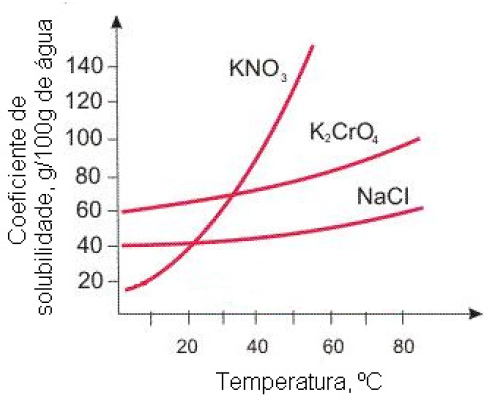
Assinale a alternativa que representa, sequencialmente, a massa (em gramas) de nitrato de potássio que é cristalizada e a massa que permanece na solução, quando uma solução aquosa saturada desse sal a 50ºC é resfriada para 20ºC.
a)90g e 40g
b)40g e 90g
c)90g e 130g
d)10g e 65g
e)05g e 40g
10 - (Univag MT/2013) A solubilidade em água do glutamato monossódico mono-hidratado, sal muito utilizado na culinária oriental para reforçar o sabor dos alimentos, é cerca de 60 g/100 mL a 20 ºC. Sabendo que a fórmula molecular dessa substância é C5H8NNaO4.H2O, conclui-se que a concentração aproximada, em mol/L, de uma solução saturada desse sal a 20 ºC é
a)4.
b)5.
c)2.
d)1.
e)3.
11 - (UNEMAT MT/2012) O coeficiente de solubilidade pode ser definido como sendo a quantidade máxima de um soluto capaz de ser dissolvida por uma determinada quantidade de solvente, sob determinadas condições de temperatura e pressão.
Sabendo-se, então, que o coeficiente de solubilidade do K2Cr2O7 é de 12,0 gramas em 100 mL de água à T=20ºC, que tipo de sistema será formado quando forem adicionadas 120 gramas de K2Cr2O7 em 600 mL de água à T=20ºC?
a)Um sistema heterogêneo, com 48 gramas de K2Cr2O7 como precipitado (corpo de fundo).
b)Um sistema homogêneo, com 48 gramas de K2Cr2O7 dissolvidas completamente.
c)Uma solução insaturada.
d)Um sistema heterogêneo, saturado, com volume final igual a 820 mL.
e)Um sistema homogêneo onde 120 gramas de K2Cr2O7 foram completamente dissolvidas.
12 - (UDESC SC/2011) A tabela a seguir refere-se à solubilidade de um determinado sal nas respectivas temperaturas:

Para dissolver 40 g desse sal à 50ºC e 30ºC, as massas de água necessárias, respectivamente, são:
a)58,20 g e 66,67 g
b)68,40 g e 57,14 g
c)57,14 g e 66,67 g
d)66,67 g e 58,20 g
e)57,14 g e 68,40 g
13 - (UESPI/2011- Adaptada) Certa substância X pode ser dissolvida em até 53g a cada 100 mL de água (H2O). As soluções formadas por essa substância, descritas a seguir, podem ser classificadas, respectivamente, como:
1.26,5g de X em 50 mL de H2O
2.28g de X em 100 mL de H2O
3.57,3g de X em 150 mL de H2O
4.55g de X em 100 mL de H2O
a)Insaturada, Insaturada, Saturada com precipitado e Saturada.
b)Saturada, Saturada, Saturada com precipitado e Insaturada.
c)Saturada com precipitado, Insaturada, Saturada e Saturada.
d)Saturada com precipitado, Insaturada, Insaturada e Saturada.
e)Saturada, Insaturada, Insaturada e Saturada com precipitado.
14 - (UESPI) Quando adicionamos sal comum (NaCl) à água, sob agitação e temperatura constantes, verificamos que, em dado momento, o sal não se dissolve mais. No caso do NaCl, isso ocorre quando há, aproximadamente, 360g de sal por 1000 mL de água. Se adicionarmos 500g de NaCl em 1000 mL de água, nas mesmas condições acima, estará preparando uma solução que será classificada como uma:
a)solução saturada sem sal precipitado.
b)solução saturada com sal precipitado.
c)solução supersaturada.
d)solução insaturada.
e)solução supersaturada instável.
15 - (UNESP SP)
No gráfico, encontra-se representada a curva de solubilidade do nitrato de potássio (em gramas de soluto por 1000 g de água).
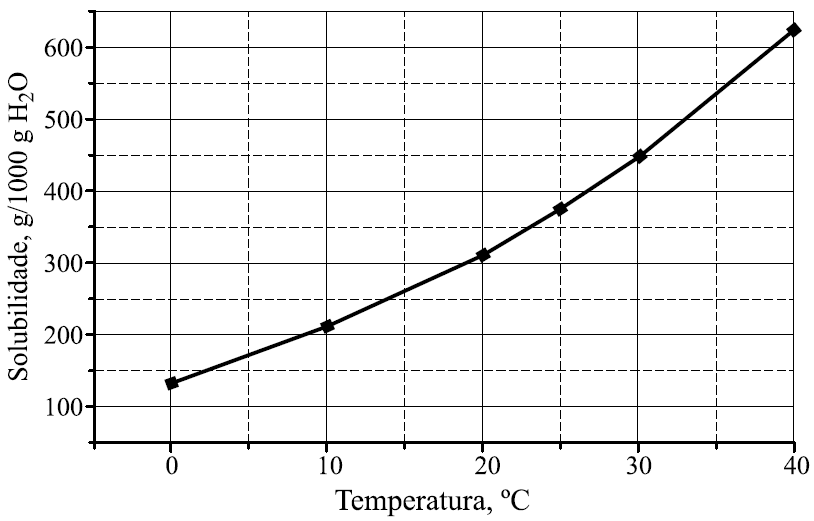
Para a obtenção de solução saturada contendo 200 g de nitrato de potássio em 500 g de água, a solução deve estar a uma temperatura, aproximadamente, igual a
a)12 °C.
b)17 °C.
c)22 °C.
d)27 ºC.
e)32 °C.
16 - (PUC SP)
O gráfico a seguir representa a curva de solubilidade do nitrato de potássio (KNO3) em água.
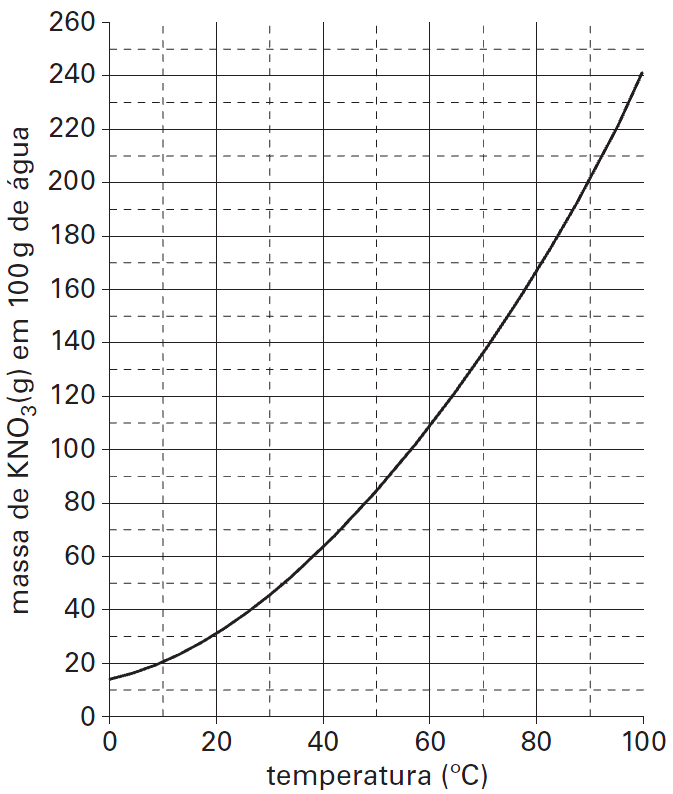
A 70ºC, foram preparadas duas soluções, cada uma contendo 70g de nitrato de potássio (KNO3) e 200g de água.
A primeira solução foi mantida a 70ºC e, após a evaporação de certa massa de água (m), houve início de precipitação do sólido. A outra solução foi resfriada a uma temperatura (t) em que se percebeu o início da precipitação do sal.
A análise do gráfico permite inferir que os valores aproximados da massa m e da temperatura t são, respectivamente,
a)m = 50g e t = 45ºC
b)m = 150g e t = 22ºC
c)m = 100g e t = 22ºC
d)m = 150g e t = 35ºC
e)m = 100g e t = 45ºC
17 - (UFV MG)
A solubilidade do nitrato de potássio (KNO3), em função da temperatura, é representada no gráfico abaixo:
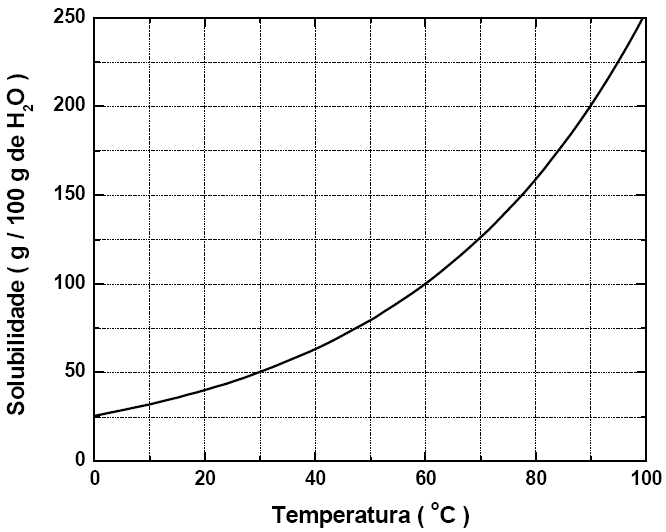
De acordo com o gráfico, assinale a alternativa que indica CORRETAMENTE a massa de KNO3, em gramas, presente em 750 g de solução, na temperatura de 30 °C:
a)250
b)375
c)150
d)100
e)500
18 - (PUC Camp SP/2012 - Adaptada)
A fábrica de pele
As seguintes etapas são utilizadas pela “fábrica de pele” alemã para produzir 100 discos de pele reconstituída a partir de uma amostra, num processo que dura 6 semanas.
1a etapa: Com uma biópsia, extrai-se um pequeno pedaço de pele do voluntário.
2a etapa: Um braço robótico corta a pele em pedacinhos.
3a etapa: Com a ajuda de enzimas, uma máquina separa dois tipos de células: os queratinócitos, da superfície, e os fibroblastos, que compõem a parte interna da pele.
4a etapa: Os dois tipos são cultivados em biorreatores e se replicam. As células produzem colágeno, proteína que ajuda a unir e fortalecer os tecidos.
5a etapa: Os fibroblastos são despejados em frascos onde formam a derme. Nutrientes são adicionados para ajudar no processo.
6a etapa: Por cima da derme são acrescentados os queratinócitos, que ajudam a formar a epiderme.
7a etapa: Fica tudo numa incubadora a 37 ºC até a pele adquirir a forma final. O resultado tem as mesmas camadas que formam o tecido humano: derme, epiderme e subdivisões.
(Adaptado: Revista Galileu, julho de 2011, p. 47)
Nutrientes para a pele, como as vitaminas A e E, ajudam a reduzir os danos causados pelos radicais livres, graças às suas fortes propriedades antioxidantes.
A dose diária de vitamina C recomendada para satisfazer as necessidades do corpo é de 100 mg. Assim, ao dissolver essa quantidade de vitamina C em meio copo d’água (cerca de 100 mL), obtém-se uma solução de vitamina C de concentração, em g/L, de, aproximadamente,
a)0,1
b)0,2
c)0,5
d)0,8
e)1,0
19 - (FMJ SP/2014) Considere as informações sobre o brometo de ipratrópio, fármaco empregado no tratamento de doenças respiratórias como bronco dilatador.
Estrutura:
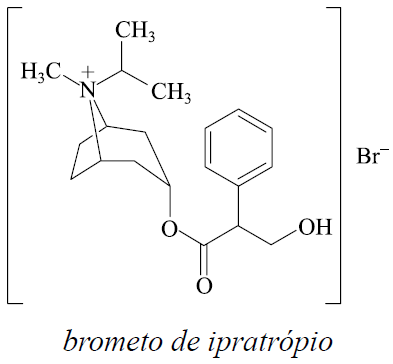
Massa molar aproximada: 4 × 102 g/mol
Informação extraída da bula:
Cada mL (20 gotas) da solução para inalação contém:
brometo de ipratrópio........... 0,25 mg
veículo q.s.p. ........................ 1 mL
(cloreto de benzalcônio, edetato dissódico, cloreto de sódio, ácido clorídrico e água purificada.)
A quantidade de brometo de ipratrópio, em mol, que entra no organismo do paciente a cada mililitro de solução inalada é, aproximadamente,
a)2 x 10–5.
b)3 x 10–7.
c)6 x 10–7.
d)3 x 104.
e)6 x 105.
20 - (Unicastelo SP/2014) Utilize as informações reunidas na tabela, obtidas do rótulo de uma água mineral natural.
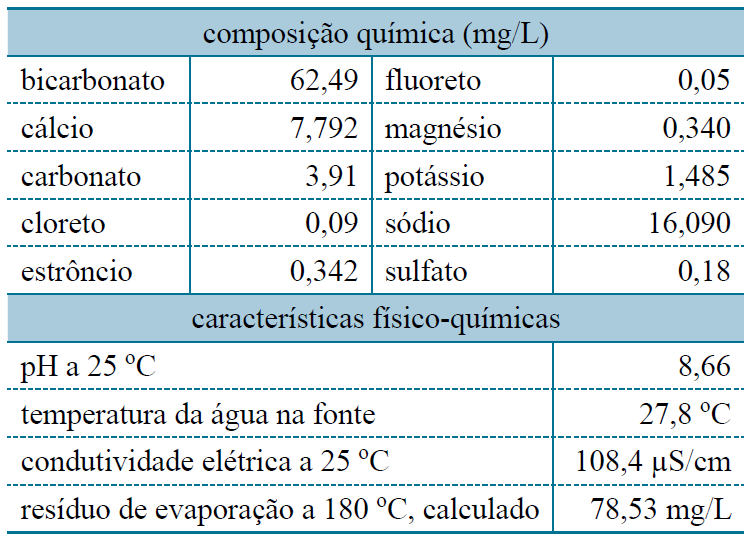
Segundo as informações da tabela, a massa total de íons de metais alcalino-terrosos dissolvidos nessa água, em mg/L, é igual a
a)4,180.
b)8,132.
c)17,575.
d)8,474.
e)0,682.
21 - (UFSCAR SP/2013) Após a conclusão do ensino médio, uma jovem estudante começou a se preparar para a realização das provas de vestibulares de algumas universidades. Em certo dia, durante os estudos, sentiu azia estomacal. Preocupada, sua mãe dissolveu todo o conteúdo de um envelope de medicamento num copo d’água (200 mL) e deu para a filha tomar. Após o alívio estomacal, a estudante pediu para ver o envelope do medicamento e anotou a sua composição:
• bicarbonato de sódio: 2,10 g
• carbonato de sódio: 0,50 g
• ácido cítrico: 2,25 g
A estudante, entusiasmada, recordou das aulas de química e lembrou-se de alguns conceitos, como soluções e reações químicas, especialmente da reação entre o carbonato de sódio e o ácido produzido pelo estômago, o HCl:
xHCl + yNa2CO3 zNaCl + wCO2 + uH2O
Se o envelope do medicamento contivesse somente bicarbonato de sódio (2,10 g) e se o volume final do conteúdo do copo d’água não se alterasse após a dissolução do medicamento, é correto afirmar que a concentração, em mol/L, de bicarbonato de sódio (massa molar 84 g/mol) nesta solução seria de
a)0,025.
b)0,050.
c)0,075.
d)0,100.
e)0,125.
22 - (Fac. Santa Marcelina SP/2014) A cafeína é muito utilizada por atletas, mas existe preocupação com o abuso do seu consumo. Recentemente, alguns estudos mostraram que os efeitos da cafeína na melhora da tolerância ao exercício prolongado devem-se ao aumento da mobilização da gordura durante o exercício, preservando os estoques de glicogênio muscular.
(www.globo.com. Adaptado.)
O gráfico representa a curva de solubilidade da cafeína em água.
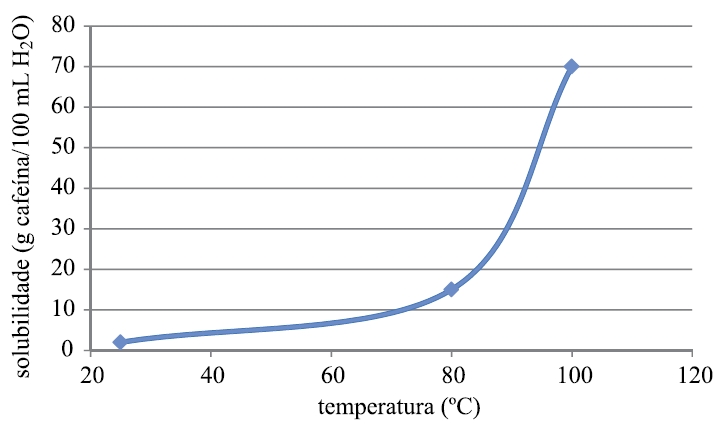
Quando uma solução saturada de cafeína contendo 200 mL de água é resfriada de 100 ºC para 80 ºC, a quantidade máxima de cafeína cristalizada, em gramas, será igual a
a)110.
b)70.
c)35.
d)55.
e)15.
23 - (ESCS DF/2014) Há muitos séculos, a humanidade aprendeu a utilizar as propriedades biológicas de substâncias presentes nas plantas. Por exemplo, no século V a.C., o médico grego Hipócrates relatou que a casca do salgueiro branco (Salix alba) aliviava dores e diminuía a febre. O responsável por essas atividades terapêuticas é o ácido salicílico, gerado pela metabolização, pelas enzimas do fígado, da salicilina presente no salgueiro. O ácido salicílico, apesar de suas propriedades terapêuticas, provoca lesões nas paredes do estômago. Para solucionar esse problema, a molécula foi modificada pelo laboratório alemão Bayer, em 1897, por meio da inserção de um grupo acetil. Assim surgiu o ácido acetilsalicílico, primeiro fármaco sintético empregado na terapêutica e que é hoje o analgésico mais consumido e vendido no mundo. A seguir, são apresentadas as estruturas moleculares da salicilina, do ácido salicílico e do ácido acetilsalicílico.
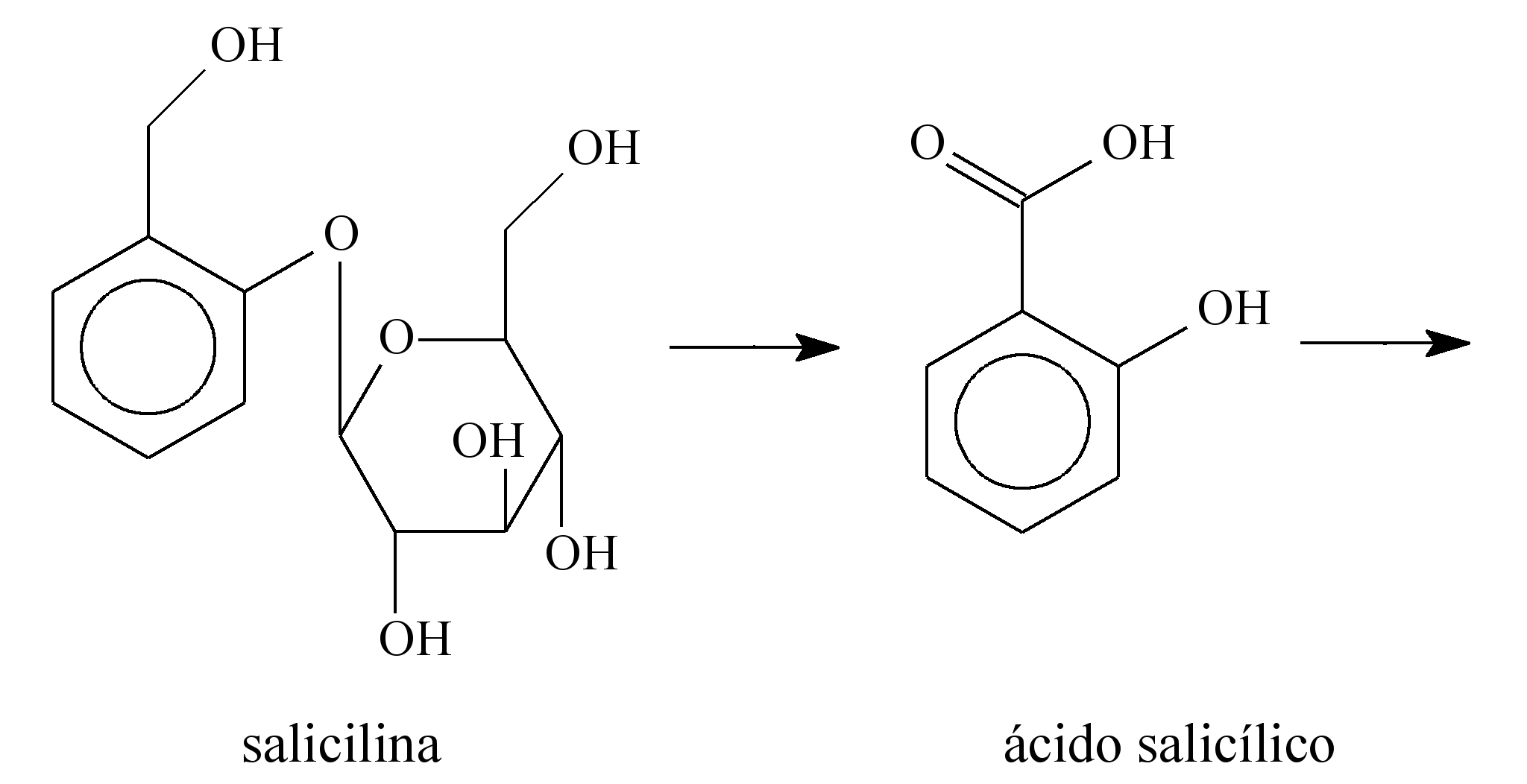
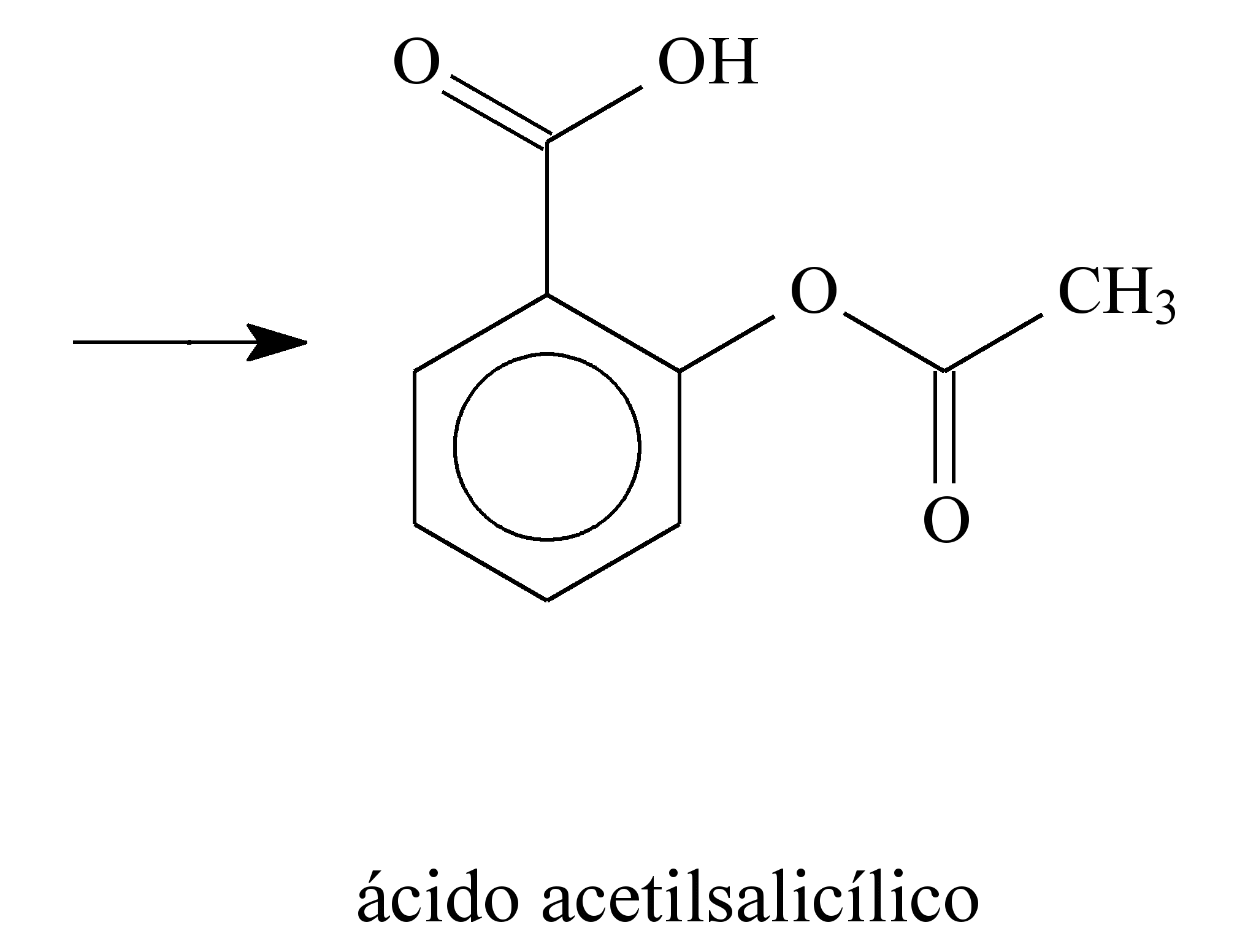
O ácido acetilsalicílico é pouco solúvel em água e, por isso, é comercializado na forma de comprimido. Considere que a massa molar e a solubilidade do ácido acetilsalicílico sejam iguais a 180 g/mol e 0,225 g em 100 mL de água, respectivamente. Desprezando-se a variação de volume decorrente da adição do ácido em água, uma solução aquosa saturada de ácido acetilsalicílico apresenta concentração de ácido dissolvido igual a
a)1,25 × 10–2 mol/L.
b)2,25 × 10–2 mol/L.
c)1,25 g/L.
d)18,0 g/L.
24 - (Unicastelo SP/2013) Para economizar água, basta fechar a torneira. Por exemplo, escovar os dentes por cinco minutos com a torneira aberta gasta, em média, 12 litros de água, enquanto que molhar a escova, fechar a torneira e bochechar com um copo d’água, gastam 0,3 L. Considerando que a densidade da água é 1 g.mL–1 e a constante de Avogadro 6,0×1023 mol–1, a economia, em número de moléculas de água, H2O, demonstrada é de, aproximadamente,
a)1x1026.
b)2x1026.
c)4x1026.
d)8x1026.
e)1x1027.
25 - (ESCS DF/2011) Para tentar explicar a presença de clorometano e diclorometano em amostras recolhidas em Marte pela sonda Viking, cientistas aqueceram uma mistura de percloratos com o solo do deserto do Atacama, no Chile, possivelmente similar ao solo marciano. As reações químicas da experiência destruíram os compostos orgânicos do solo, liberando traços de clorometano e diclorometano como os encontrados pela sonda.Considerando que em uma amostra foram encontradas 6 x 1015 moléculas de clorometano e 1,2 x 1017 moléculas de diclorometano, os números de mols aproximados de clorometano e de diclorometano são, respectivamente:
a)1 x 10–9 e 2 x 10–7;
b)1 x 10–8 e 2 x 10–7;
c)1 x 10–6 e 5 x 10–6;
d)1 x 106 e 2 x 108;
e)1 x 108 e 5 x 106.
26 - (ACAFE SC/2014) No jornal Folha de São Paulo, de 14 de junho de 2013, foi publicada uma reportagem sobre o ataque com armas químicas na Síria ´´[...] O gás sarin é inodoro e invisível. Além da inalação, o simples contato com a pele deste gás organofosforado afeta o sistema nervoso e provoca a morte por parada cardiorrespiratória. A dose letal para um adulto é de meio miligrama. […]”.Baseado nas informações fornecidas e nos conceitos químicos, quantas moléculas aproximadamente existem em uma dose letal de gás sarin aproximadamente?
Dado: Considere que a massa molar do gás sarin seja 140g/mol.
a)1,68x1026 moléculas.
b)3,00x1023 moléculas.
c)2,14x1021 moléculas.
d)2,14x1018 moléculas.
27 - (UFTM MG/2013) Os “cianokits”, que são utilizados por socorristas em outros países nos casos de envenenamento por cianeto, geralmente contêm 5 g de hidroxocobalamina ( massa molar igual a 1,3 x 103 g/mol ) injetável. Considerando a constante de Avogadro igual a 6 x 1023 mol–1, calcula-se que o número aproximado de moléculas existentes nessa massa de hidroxocobalamina é
a)2 x 1021.
b)2 x 1025.
c)3 x 1025.
d)3 x 1021.
e)1 x 1021.
GABARITO:
01) A
02) D
03) A
04) C
05) E
06) C
07) E
08) D
09) A
10) E
11) A
12) C
13) E
14) B
15) D
16) B
17) A
18) E
19) C
20) D
21) E
22) A
23) A
24) C
25) B
26) D
27) A












Sem comentários:
Enviar um comentário