REVISÃO GERAL - VIÇOSA
01.(Universidade Federal de Viçosa – 2009) Grande parte dos elementos da Tabela Periódica são metais. Muitos deles fazem parte da composição de diversos materiais de uso cotidiano. Considerando as características próprias dos metais, assinale aquela que NÃO representa uma característica de metal nas condições normais de temperatura e pressão:
a) É brilhante.
b) É bom condutor.
c) É gasoso.
d) É maleável.
02. (Universidade Federal de Viçosa- 2009 - adaptada) As substâncias formadas por mais de um elemento podem conter proporções diferentes nas suas composições.

Fonte:http://www.brasilescola.com
A proporção dos elementos na substância é determinada pela análise elementar que é dada pela porcentagem de massa de cada elemento. Certa substância contém as seguintes porcentagens em massa: 1,20% em hidrogênio, 42,00% em cloro e 56,80% em oxigênio. A fórmula molecular mínima dessa substância é:
a) HClO3
b) HClO
c) HClO4
d) HClO2
03. (Universidade Federal de Viçosa - 2009- adaptada) A Glutetimida é um sedativo de fórmula molecular C13H15NO2 .

Considerando o Número de Avogadro igual a 6,0 x 1023, assinale a alternativa que apresenta CORRETAMENTE o número aproximado de átomos de oxigênio contidos em 0,1 mg desse composto:
a) 2,8 x 1017
b) 5,5 x 1017
c) 2,8 x 1020
d) 5,5 x 1020
04. (Universidade Federal de Viçosa - 2009) Utilizando a Tabela Periódica dos Elementos, assinale a afirmativa CORRETA, em relação aos elementos químicos magnésio (Mg) e cloro (Cl):
a) O magnésio forma molécula covalente polar com o cloro.
b) A primeira energia de ionização do Mg é maior do que a do Cl.
c) O raio atômico do Cl é maior do que o do Mg.
d) O magnésio reage com o cloro dando origem a um sal.
05. (Universidade Federal de Viçosa - 2009) Em um recipiente se encontra uma mistura sólida constituída de 2 gramas de cloreto de prata (AgCl) e 2 gramas de cloreto de sódio (NaCl). À temperatura ambiente, o cloreto de prata é insolúvel em água e o cloreto de sódio é solúvel. Para separar esses sais foram adicionados 50 mL de água ao recipiente. Essa mistura foi submetida a dois (2) processos de separação para obter os sais AgCl (sólido) e NaCl (sólido). Os dois (2) métodos que podem ser empregados, respectivamente, para separar esses sais são:
a) filtração e destilação.
b) decantação e filtração.
c) evaporação e sublimação.
d) destilação e evaporação.
06. (Universidade Federal de Viçosa – 2009) Faça a correlação entre a coluna da esquerda (fórmulas químicas de substâncias) e a da direita (tipos de ligação).
( ) H2O ( 1 ) iônica
( ) KI ( 2 ) covalente polar
( ) CO2 ( 3 ) covalente apolar
( ) BaCl2
( ) Cl2
( ) NH3
A sequência CORRETA é:
a) 2, 3, 2, 2, 3, 3.
b) 1, 1, 3, 3, 2, 1.
c) 2, 1, 2, 1, 3, 2.
d) 3, 2, 3, 1, 2, 2.
07. (Universidade Federal de Viçosa - 2009 - adaptada) A maioria dos protetores solares contém em sua formulação óxido de zinco.
Sobre o zinco e seu óxido, é CORRETO afirmar:
a) O zinco apresenta o nível “3” incompleto.
b) A fórmula molecular do óxido de zinco é ZnO.
c) A massa molar do óxido de zinco é igual a 97,4 g/mol.
d) O oxigênio tem menor afinidade por elétrons que o zinco.
08. (Universidade Federal de Viçosa - 2009 - adaptada) O ácido sulfúrico, composto químico de fórmula molecular H2SO4, é o principal ácido derivado do enxofre.

Nessa molécula, o átomo de enxofre ocupa uma posição central entre os quatro átomos de oxigênio. As ligações que se estabelecem entre os átomos de oxigênio e o átomo de enxofre são:
a) 2 ligações covalentes duplas e 2 ligações covalentes simples.
b) 2 ligações covalentes simples e 2 ligações iônicas.
c) 2 ligações covalentes duplas e 2 ligações iônicas.
d) 3 ligações covalentes duplas e 1 ligação covalente simples.
09. (Universidade Federal de Viçosa - 2009 - adaptada) O permanganato de potássio (KMnO4) é forte agente oxidante, que em solução aquosa apresenta uma coloração violeta bastante intensa.

Esse sal inorgânico é formado pelos íons potássio (K+) e permanganato (MnO4–1). Nesse sal, o estado de oxidação do Mn é:
a) + 4
b) + 2
c) + 5
d) + 7
10. (Universidade Federal de Viçosa - 2009) Em um laboratório de química, cinco frascos estão identificados como sendo as substâncias Fe2O3, BaCl2, Mg(OH)2, HClO4 e K2Cr2O7, que pertencem, respectivamente, às funções químicas:
a) sal, base, ácido, óxido, óxido.
b) óxido, sal, base, ácido, sal.
c) óxido, sal, base, ácido, óxido.
d) sal, base, sal, óxido, sal.
2ª FASE
11. (Universidade Federal de Viçosa – 2009) A reação representada por 2NO (g) → N2 (g) + O2 (g) apresenta as seguintes etapas:
1a Etapa (lenta): 2 NO (g) + O2 (g) → 2 NO2 (g)
2a Etapa (rápida): 2 NO2 (g) → N2 (g) + 2 O2 (g)
A respeito dessa reação, é INCORRETO afirmar que:
a) a etapa determinante da reação é a primeira.
b) o complexo ativado, espécie intermediária dessa reação, é o NO2.
c) na segunda etapa da reação ocorre a decomposição do NO2.
d) a etapa determinante dessa reação é a segunda.
12. (Universidade Federal de Viçosa – 2009) Os valores de energia de ligação na tabela abaixo são conhecidos, a 25 0C.
Ligação Energia KJ/mol da ligação formada
H - Cl - 431,8
H - F - 563,2
Cl - Cl - 242,6
F - F - 153,1
Para a reação representada por:
2 HCl (g) + F2 (g) → 2 HF (g) + Cl2 (g)
Assinale a alternativa que apresenta a variação de entalpia, calculada a partir dos dados da tabela:
a) - 584,9 Kj, sendo a reação endotérmica.
b) - 352,3 Kj, sendo a reação exotérmica.
c) + 220,9 Kj, sendo a reação exotérmica.
d) + 352,3 Kj, sendo a reação endotérmica.
13. (Universidade Federal de Viçosa – 2009) A bauxita, de fórmula Al2O3.2H2O, é um minério a partir do qual se obtém o alumínio, um metal de grande aplicabilidade devido à sua leveza e boa condutibilidade térmica. Após a eliminação da água, obtém-se o alumínio usando-se a eletricidade, conforme a equação abaixo:
2 Al2O3 → 4 Al + 3 O2
Para a reação representada, é CORRETO afirmar que:
a) o Al sofre oxidação, devido ao aumento de seu NOX.
b) o Al sofre redução, devido ao aumento de seu NOX.
c) o oxigênio é o agente oxidante, pois sofre redução.
d) o oxigênio é o agente redutor, pois sofre oxidação.
14. (Universidade Federal de Viçosa – 2009) O suco gástrico produzido pelo estômago durante o processo de digestão apresenta ácido clorídrico (HCl) numa concentração aproximada de 0,01 mol/L. Sabendo que durante a digestão é produzido cerca de 0,1 L de suco gástrico, a massa em gramas de HCl contida nesse volume é de:
a) 0,1 g
b) 0,365 g
c) 0,0365 g
d) 0,001 g
15. (Universidade Federal de Viçosa – 2009) Sabe-se que os íons bário (Ba2+) são extremamente tóxicos ao organismo humano, porém são utilizados na medicina como contrastantes radiológicos. O sulfato de bário (BaSO4) é um sal pouquíssimo solúvel em água, sendo utilizado pela indústria farmacêutica como um contrastante radiológico em forma de suspensão. Normalmente, a suspensão é preparada em uma solução de sulfato de potássio (K2SO4), um sal bastante solúvel em água. A função do sulfato de potássio nessa situação é:
a) deslocar o equilíbrio no sentido de formação do sulfato de bário, através da ação do íon comum.
b) deslocar o equilíbrio no sentido de formação de íons Ba2+.
c) aumentar o valor da constante do produto de solubilidade do sulfato de bário.
d) aumentar a eficiência do contrastante ao liberar mais íons Ba2+.
16. (Universidade Federal de Viçosa – 2009 - adaptada ) A presença de óxidos de enxofre na atmosfera contribui para a formação da chuva ácida, que causa grandes prejuízos ambientais.
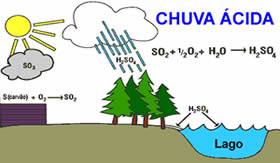
Fonte:http://www.mundoeducacao.com/
Essa reação pode ser descrita de maneira simplificada pela equação a seguir:
SO3 (g) + H2O (v) → H2SO4 (v)
Considerando que nas condições ambientais essa reação processa-se com um rendimento de 10%, a massa de ácido sulfúrico resultante da hidratação de 0,10 mols de óxido de enxofre é: (Dados: massa molar (g/mol): S = 32,1; H = 1,0; O = 16,0)
a) 9,81
b) 0,0981
c) 0,981
d) 0,00981
17. (Universidade Federal de Viçosa – 2009) A Regra do Octeto foi proposta por G. Lewis no início do século XX, visando explicar a estabilidade e a estrutura eletrônica dos compostos químicos mais comuns. Foi usada como modelo a estrutura eletrônica dos gases nobres onde, com exceção do He, a camada de valência apresenta-se preenchida com oito elétrons.
Dos compostos abaixo, assinale aquele que, com base na Tabela Periódica, NÃO pode ser explicado por essa regra:
a) NH3
b) BCl3
c) PF3
d) H2S
18. (Universidade Federal de Viçosa – 2009) O biodiesel é um combustível renovável obtido por transformações químicas de óleos extraídos de plantas ou gorduras animais. Considerando uma mistura à temperatura ambiente de três porções de volumes iguais de água, álcool etílico e biodiesel, assinale a alternativa que apresenta CORRETAMENTE os números de fases, de estados físicos e de compostos orgânicos presentes nessa mistura:
a) 2, 1, 3.
b) 2, 3, 2.
c) 3, 2, 3.
d) 2, 1, 2.
19. (Universidade Federal de Viçosa – 2009) O NaCl, principal componente do sal de cozinha, o CaO, um dos componentes do gesso, o BF3In, cristal líquido usado em dispositivos eletrônicos como telas de celulares, e o NH4Cl, resultante da reação entre HCl e amônia, são exemplos de compostos com grande caráter iônico.
É CORRETO afirmar que todo composto iônico é:
a) condutor de eletricidade, no estado líquido.
b) solúvel em água.
c) sólido na temperatura ambiente.
d) formado por metais e ametais.
20. (Universidade Federal de Viçosa – 2009) A Tabela Periódica é organizada segundo a estrutura eletrônica dos átomos. Como exemplo, o período ocupado por um elemento indica o número de níveis (camadas) de elétrons e o grupo (coluna) para os elementos representativos indica o número de elétrons de valência. Consequentemente, as propriedades periódicas são dependentes dessa estrutura.
Com base nesse conhecimento, assinale a afirmativa CORRETA:
a) Num mesmo período, o aumento do número atômico resulta, na maioria das vezes, no aumento do raio atômico.
b) A energia de ionização pode ser descrita simplificadamente como a energia necessária para se retirar o elétron de valência de um átomo neutro e é, na maioria das vezes, inversamente proporcional ao raio atômico.
c) Na Tabela Periódica, todos os elementos de uma mesma família apresentam o mesmo estado físico.
d) Energia de ionização é uma propriedade que aumenta sempre com o aumento do número atômico.



Sem comentários:
Enviar um comentário