a) Desidratação intramolecular — nessa reação ocorre a eliminação de uma molécula de água do interior de cada molécula de álcool:
b) Desidratação intermolecular — nessa reação ocorre a eliminação de uma molécula de água a partir de duas moléculas de álcool, pela interação dos grupos OH, através das pontes de hidrogênio
Como, nessas reações, o produto orgânico obtido é proveniente de uma simples retirada de átomos do reagente, elas podem ser classificadas como reações de eliminação.
Esterificação
Essa reação ocorre quando um ácido reage com um álcool, produzindo éster e água; a reação inversa é denominada reação de hidrólise.
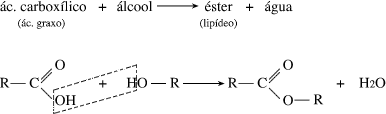
Quando essas reações ocorrem entre um ácido carboxílico e um álcool primário, a água é formada pelo grupo OH do ácido e pelo hidrogênio do grupo OH do álcool.
Caso se utilizem ácidos inorgânicos ou álcoois secundários ou terciários, a água será formada pelo OH do álcool e pelo hidrogênio do grupo OH do ácido.
I - Hidratação de alquenos

II - Redução
A redução é a reação inversa à oxidação e é realizada com o gás hidrogênio (H2).
• Redução de ácidos carboxílicos e aldeídos
• Redução de uma cetona
Outra maneira de obter álcoois em laboratório consiste em fazer a reação entre um haleto orgânico (R — X) e o hidróxido de potássio em solução aquosa [KOH(aq)].
Os aldeídos e as cetonas são os principais compostos carbonílicos (grupo carbonila , e as principais reações que ocorrem nesse grupo envolvem a quebra da ligação pí.
Os Os aldeídos e as cetonas reagem com os compostos de Grignard (R—MgX), originando um composto intermediário que se hidrolisa e dá origem a diferentes álcoois, segundo o esquema:(R—MgX), originando um composto intermediário que se hidrolisa e dá origem a diferentes álcoois, segundo o esquema:
I - Reação de redução
Nesse tipo de reação, utiliza-se gás hidrogênio (H2)

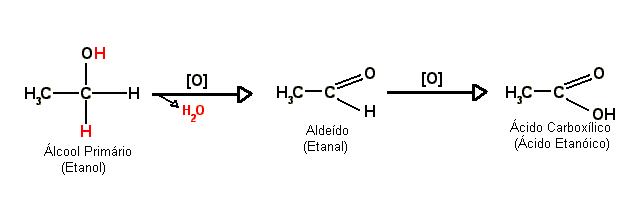
II -Reação de oxidação
As reações de oxidação podem ser feitas utilizando-se agentes oxidantes, tais como KMnO4, K2Cr2O7 .
. 

PARA DIFERENCIAR UM ALDEÍDO DE UMA CETONA PODEMOS:
A - Podemos usar o Reativo de Tollens — solução aquosa amoniacal de nitrato de prata.
B - Podemos usar o Reativo de Fehling — solução aquosa de sulfato de cobre em meio básico e tartarato duplo de sódio e potássio.
C - Podemos usar o Reativo de Benedict — solução aquosa de sulfato de cobre em meio básico e citrato de sódio.
Os principais métodos de obtenção de aldeídos e cetonas, já vistos anteriormente, são os seguintes:
A - Hidratação de alcinos
B - Ozonólise de alcenos
C - Oxidação de álcoois
muito importantes no nosso cotidiano,os ácidos carboxílicos mais conhecidos são: o ácido fórmico, o ácido acético, Butanóico ou Butírico, hexanóico ou Cáprico.
Cheiro de manteiga Rançosa e cheiro de cabra.
a) aqueles que aumentam a acidez. Exemplos: halogênios (F, Cl, Br, I); NO2; OH etc.
b) aqueles que diminuem a acidez. Exemplos: H3C ; C2H5 etc.
O que caracteriza o grau da acidez dos ácidos é a constante de ionzação. Quanto maior a constante de ionização (Ki), mais ionizado estará o ácido.
Assim, entre os ácidos apresentados, temos:
I - Esterificação
Os ácidos carboxílicos reagem com os álcoois, produzindo éster e água.

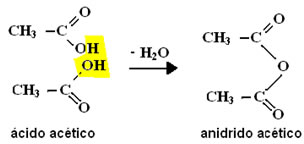
II - Desidratação intermolecular
Nesse tipo de reação ocorre a eliminação de uma molécula de água a partir de duas moléculas de ácido carboxílico, originando um anidrido:
Durante o nosso estudo, já foram abordados alguns métodos de obtenção dos ácidos carboxílicos:
I - oxidação enérgica de alcenos
II - oxidação de aldeído
III - oxidação de álcool primário
IV - hidrólise de éster
Os ácidos carboxílicos também podem ser obtidos pela hidrólise de haleto ácido.
Os ésteres são substâncias muito abundantes na natureza e podem ser classificados em três grupos: essências de frutas, lípides e ceras.
Essências de frutas Os ésteres de ácidos e álcoois com pequeno número de átomos de carbono compõem o grupo das essências de frutas. Veja alguns exemplos desses ésteres:
Lípides Os lípides são também chamados de lipídeos ou lipídios.
Os mais importantes são os óleos e as gorduras, que apresentam estruturas semelhantes e são elaborados por organismos vivos a partir de ácidos graxos e glicerol.
Como na estrutura do lipídeo existem três grupos (-COO-), ele é classificado como um triéster e é também denominado triglicérido ou triglicerídeo.
Um triglicérido pode ser obtido a partir de diferentes ácidos graxos e apresentar até três radicais diferentes (R, R’ e R”).
Quando pelo menos dois desses radicais forem saturados, o triglicérido é classificado como gordura.
As gorduras são geralmente de origem animal e, à temperatura ambiente, apresentam-se no estado sólido.
Quando prevalecem radicais insaturados, esse triglicérido é um óleo.
Os óleos geralmente são de origem vegetal e, à temperatura ambiente, apresentam-se no estado líquido.
Gorduras: predominam radicais de ácidos graxos saturados e são sólidas a temperatura ambiente.

Óleos: predominam radicais de ácidos graxos insaturados e são líquidos a temperatura ambiente..
Ceras: São uma mistura complexa de vários compostos orgânicos, seus principais constituintes são ésteres de ácidos graxos e álcoois de cadeia longa, ambos não-ramificados.
FONTE DOS TEXTOS
Professor Eudo Robson
Tito e Canto
Ricardo Feltre
Geraldo Camargo
Usberco e Salvador
FONTE DAS IMAGENS
Professor Eudo Robson
http://www.apoloartes.com.br/
Livro de Usberco e Salvador
http://hypescience.com/
http://www.adnbiodiesel.com.br/
http://www.alunosonline.com.br/
http://www.brasilescola.com/
http://www.revistaberro.com.br/
http://www.curaeascensao.com.br/




























Sem comentários:
Enviar um comentário