MASSA MOLECULAR OU PESO MOLECULAR
Ex.: Calcule a massa atômica do AgNO3
. Dados: Ag - 108, N - 14 e O - 16
Ag - 108 x 1 = 108
N – 14 x 1 = 14
O – 16 x 3 = 48
170 u.m.a (unidade de massa atômica)
NÚMERO DE MOLS
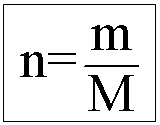
Ex.: Quantos mols são encontrados em 180g de água?
H2O H = 1 x 2 = 2 n = 180/ 18 = 10 mols O = 16 x 1 = 16 18
REAÇÕES QUÍMICAS

Fonte:http://vestibular.unoesc.edu.br/
MEMBROS DE UMA REAÇÃO

II - PRODUTOS (C e D) - São as substâncias resultantes da transformação.
 2HI
2HI 2HgO
 2Hg + O2
2Hg + O2HCl + NaOH
 NaCl + H2O
NaCl + H2O- A representação gráfica, vista por meio de fórmulas no exemplo acima, é denominada de EQUAÇÃO QUÍMICA.
NOMENCLATURAS USADAS NAS REAÇÕES QUÍMICAS
FOTÓLISE - Reação que ocorre na presença de luz. Ex: fotossíntese.
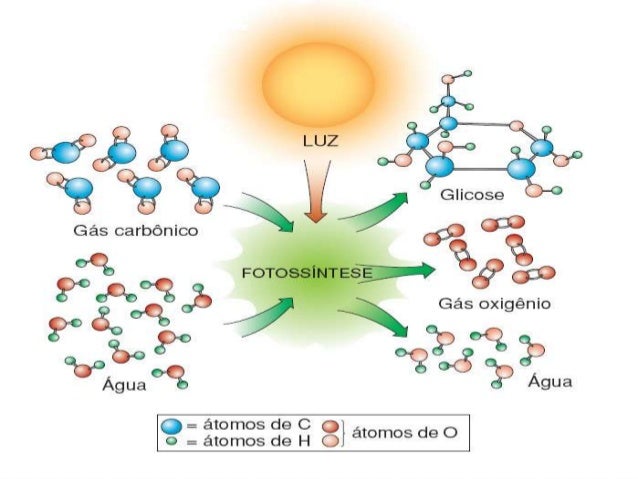
Fonte:http://pt.slideshare.net/
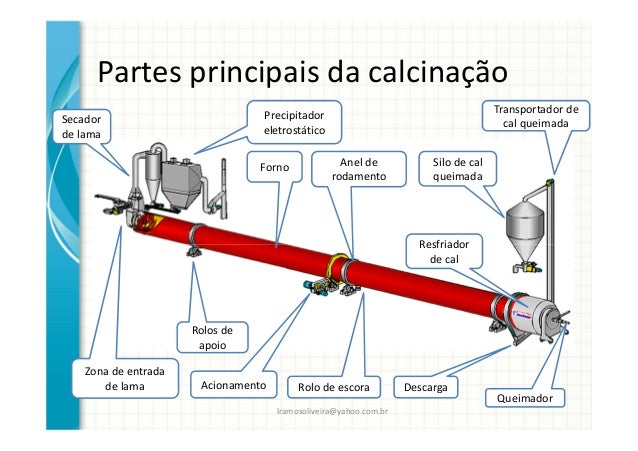
Fonte:http:http://pt.slideshare.net/
Ex: Calcinação do Calcário. CATÀLISE - Reação que ocorre na presença de um catalisador.
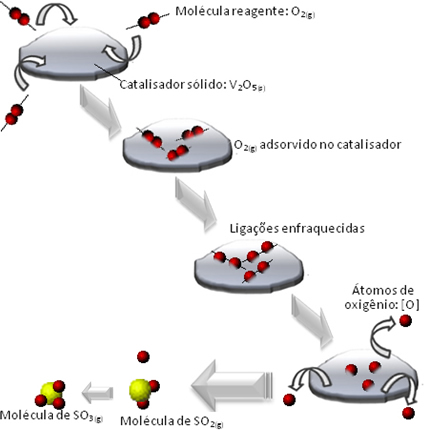
Fonte:http://www.brasilescola.com/
Ex: Expulsão do oxigênio da água oxigenada diante do permanganato de potássio. ELETROLISE- Reação que ocorre diante de uma corrente elétrica.
Fonte:http://www.quimica.ufpb.br/
Ex: Douração, cobreamento, ouração de objetos.
QUANDO OCORRE UMA REAÇÃO ?
1.º) Suas moléculas sejam postas no melhor contato possível.
SÓLIDO ˂ LÍQUIDO ˂ GÁS ( pois aumenta a superfície de contato )
PEDAÇOS ˂ RASPAS ˂ PÓ ( pois aumenta a superfície de contato )
2.º) Os reagentes tenham uma certa afinidade (vontade de reagir). Foi testado experimentalmente e criou-se as tabelas abaixo.
PARA OS METAIS
PARA OS AMETAIS
FATORES QUE INFLUENCIAM UMA REAÇÃO
A - CATALISADORES
São substâncias que podem acelerar uma reação, quando do seu aumento.
Ex.: O KMnO4- , o paládio (Pd), a platina (Pt) e o níquel (Ni) são catalisadores utilizados na hidrogenização do óleo que produz a margarina. O íon MnO4- , é o catalisador que faz o oxigênio sair da água oxigenada.
KMnO4 + 2 H2O2
 2 H2O + O2
2 H2O + O2
B - TEMPERATURA
É um dos fenômenos físicos que tendem acelerar ou diminuir a velocidade de uma reação.
Ex.: Quando colocamos um comprimido efervescente num copo com água fria, ele reage mais lentamente do que, se o colocarmos num copo com água à temperatura ambiente. Por isso não devemos guardar o queijo fatiado e sim em pedaços.
CLASSIFICAÇÃO DAS REAÇÕES
- As reações podem ser classificadas de diversas maneiras, vejamos algumas delas:
A - QUANTO AO CALOR
- São aquelas que só ocorrem na presença de calor, isto é precisam de calor para que o fenômeno ocorra.
Ex.: N2 + O2 + CALOR
 2NO, a fotossíntese ...
2NO, a fotossíntese ...
A2 - REAÇÕES EXOTÉRMICAS
- São aquelas que liberam calor.
B - QUANTO À VELOCIDADE

Fonte:http://cerpolo.com.br/
Ex.: a ferrugem: 4 Fe + 3O2
 2 Fe2O3
2 Fe2O3B2 - REAÇÕES RÁPIDAS - São aquelas que ocorrem rapidamente. Ex.: combustão da madeira do álcool, do papel, da gasolina...
C - QUANTO À VARIAÇÃO DAS SUBSTÂNCIAS ENVOLVIDAS
C1 - REAÇÃO DE SÍNTESE OU ADIÇÃO - Ocorre quando duas substâncias reagem produzindo uma única substância mais complexa.
C2 - REAÇÃO DE ANÁLISE OU DECOMPOSIÇÃO - Ocorre quando uma substância composta, se divide em duas ou mais substâncias simples ou compostas.

 2Hg
+ O2
2Hg
+ O2
C3 - REAÇÃO DE DESLOCAMENTO, SUBSTITUIÇÃO OU SIMPLES TROCA - Quando uma substância simples reage com uma substância composta, deslocando desta última, ou o cátion ou o ânion, para formar uma nova substância simples.

C4 - REAÇÃO DE DUPLA TROCA OU DUPLA SUBSTITUIÇÃO - Ocorre quando duas substâncias compostas reagem, permutando entre si, dois elementos ou radicais, dando origem a dois novos compostos.

BALANCEAMENTO DE REAÇÕES QUÍMICAS
- Em todas as reações, para que não haja perdas, é necessário que a quantidade dos reagentes seja igual à dos produtos formados. É para isso que as mesmas devem ser balanceadas.
COEFICIENTE - É o número escrito antes da fórmula de uma substância, que indica o número de moléculas que entram na reação. Veremos apenas dois, são eles: o das tentativas e o algébrico.
A - MÉTODO DAS TENTATIVAS
REGRAS PRÁTICAS
1º - Observar o elemento, ou radical, que aparece apenas uma vez no primeiro e segundo membros da reação.
2º - Preferir o elemento ou radical de maior índice.
3º - Escolhido o elemento ou radical, transpor seus índices de um membro para o outro, usando-os como coeficientes.
4º - Prosseguir com os outros elementos ou radicais, usando o mesmo raciocínio, até o final do balanceamento.
Ex1.: Balancear a reação abaixo: Fe + O2
 Fe2O3
Fe2O32º passo - preferir o O2, pois tem maior índice;
3º passo - transpor os índices: Fe + 3O2
 2Fe2O3
2Fe2O34º passo - completar o que falta: 4Fe + 3O2
 2Fe2O3
2Fe2O3Resposta: 4 Fe + 3 O2
 2 Fe2O3
2 Fe2O3Ex2: Balancear a reação:
1º membro 2º membro
Mn – l x 3 = 3 Mn - 3 X 1 = 3
P – 2 x 1 = 2 P - 1 x 2 = 2
O – 3 + 5 = 8 O - 8
Resposta: 3 MnO + 1 P2O5
 1 Mn3(PO4)2
1 Mn3(PO4)2B - MÉTODO ALGÉBRICO
- Neste método utilizamos equações algébricas. Resolve-se o sistema de equações dando um valor arbitrário a uma das incógnitas. Os coeficientes formarão proporções entre as moléculas.
Ex.: Balancear a equação:
1.º passo -
Coloca-se as incógnitas no lugar de cada coeficiente.
2.º passo - Arrumam-se
as equações.
· para o H, temos: 3a + 2b
= 2d
· para o O, temos: 3a +
2b = 6c + d
· para o B, temos: a = 2c
· para o Ca, temos: b = 3c
3.º passo -
Atribui-se um valor inteiro a uma das incógnitas. De preferência o menor
valor possível.
· c = 1
4º passo -
Calcula-se o valor de todas as incógnitas.
· c = 1
· a = 2 . 1
a = 2
· b = 3 . 1
b = 3
· 3 . 2 + 2 . 3
= 2d
6 + 6 = 2d
12 = 2d
d = 6
5º passo - Substitui as letras pelos números.
Pronto está
balanceada !








Sem comentários:
Enviar um comentário