A molécula de água é composta por dois átomos de
hidrogênio e um de oxigênio, com estrutura angular sendo considerada uma
molécula polar.
Na natureza, a água é o componente químico que está
presente em maior quantidade nos seres vivos e, juntamente com os sais
minerais, constitui os componentes inorgânicos das células.
As substâncias orgânicas predominam em variedade, pois
é grande o número de proteínas, ácidos nucléicos, lipídios e carboidratos
diferentes que formam a estrutura das células e dos organismos.
As moléculas de água se unem por pontes de hidrogênio onde
o átomo de hidrogênio polarizado com carga parcial positiva é atraído por um
átomo de oxigênio de outra molécula com carga parcial negativa.
A formação de dipolos na molécula é resultante da
grande diferença de eletronegatividade entre os átomos de hidrogênio e o de
oxigênio.
Devido a essas interações (ligação de hidrogênio) a
água apresenta alto ponto de fusão e ebulição sendo considerada um excelente
solvente para substâncias iônicas e outras moléculas polares que façam ligação
de hidrogênio com a água como aldeídos, álcool, cetonas e açúcares.
A água é considerada como solvente universal pois tem a
capacidade de solubilizar inúmeros compostos orgânicos e inorgânicos,
transportando-os pelo organismo. É o solvente do sangue, da linfa, dos líquidos
intersticiais nos tecidos e das secreções como a lágrima, o leite e o suor.
A água enfraquece as ligações eletrostáticas e ligações
de hidrogênio entre esses grupamentos e passa a interagir com eles, como por
exemplo entre carbonila e amida.
É a fase dispersante de todo material citoplasmático. O
citoplasma nada mais é do que uma solução coloidal de moléculas protéicas,
glicídicas e lipídicas imersas em água.
Atua no transporte de substâncias entre o interior da
célula e o meio extracelular. A água impregna todos os tecidos sendo, dessa
forma, o meio de transporte dos elementos nutritivos para a célula;
Transporta as substâncias solúveis que atravessam as
membranas celulares devido ao mecanismo das pressões osmóticas. Todas as reações bioquímicas se processam
em meio aquoso já que a água é indispensável às interações entre as
biomoléculas.
A água tem um alto
calor específico, o que também é justificado pela formação de ligações de
hidrogênio.
Assim, a água tem capacidade de absorver muito calor e mudar
pouco de temperatura; isso ocorre devido à dificuldade de se romper as pontes de hidrogênio para que as
moléculas de água aumentem sua energia cinética e, por consequência, sua
temperatura.
Quanto maior o metabolismo tecidual, maior o teor
percentual de água, uma vez que a água é o meio para o metabolismo, ou seja, é
o solvente das reações bioquímicas.
Nos animais, os músculos têm maior atividade metabólica
que ossos, possuindo maior teor de água (70 a 80% enquanto no tecido ósseo essa
quantidade é de 25%).
Nas plantas, folhas têm maior atividade metabólica que
sementes, possuindo então maior teor de água.
A desidratação ocorre quando acontece uma perda de
líquidos corporais, principalmente quando há uma perca de água superior ao
montante que foi tomado, com isso, sai mais água das nossas células e, em
seguida, do nosso corpo.
Perdemos água todos os dias sob a forma de vapor de
água no ar quando expiramos, e através do nosso suor, urina e fezes. Juntamente
com a água, também são perdidas pequenas quantidades de sais.
Quando perdemos muita água e esta não é reposta, o
organismo fica fora de equilíbrio ou desidratado.
A desidratação severa pode levar à morte. É por isso que devemos ter cuidados e atenção à
desidratação. Dentre as principais causas da desidratação pode-se citar: baixa ingestão de líquidos (principalmente
a água que participa da maior parte dos processos vitais em nosso organismo); perda excessiva de líquidos corporais,
como por: vômitos, diarreia, produção excessiva de urina e exposição prolongada à luz solar.
Os principais sintomas são: aumento da sede e redução
da urina, fraqueza e fadiga, tontura e dores de cabeça, boca e/ou língua seca,
pode prejudicar as atividades renais, irritabilidade ou apatia (falta de
energia).
No caso de alguém que se encontre desidratado, deve-se
administrar o soro caseiro ou industrializado a fim de que o mesmo possa
recuperar o líquido e os sais perdidos.
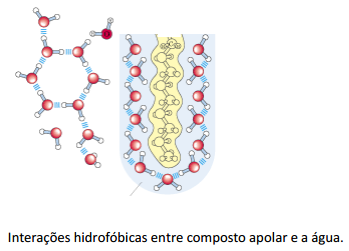
INTERAÇÕES HIDROFÓBICAS
Apesar de solubilizar uma grande parte dos solutos,
existem moléculas que interagem de forma diferente com a água pois não são
solubilizados pela mesma.
Solutos não polares ou grupos funcionais não polares
em macromoléculas biológicas não fazem ligação de hidrogênio com a água.
Dessa forma, essas moléculas tendem a se aglomerarem em
água constituindo as interações hidrofóbicas. Consideremos a introdução de uma
molécula de hidrocarboneto em água.
Cria-se uma cavidade na água, o que desfaz
temporariamente algumas ligações de hidrogênio entre as moléculas de água. As
moléculas de água deslocadas orientam-se, então, para formar o número máximo de
novas ligações de hidrogênio.
Isso é conseguido a um preço: o número de modos de formação de
ligação de hidrogênio na cavidade em torno da molécula do hidrocarboneto é muito menor que na água pura sendo
que as moléculas de água em torno da molécula do hidrocarboneto são muito mais ordenadas do que em outros locais na solução.
A água é
altamente coesa na qual as moléculas vizinhas de água têm alta afinidade umas
pelas outras.
FONTE DOS TEXTOS
Prof. Abel Scupeliti Artilheiro







Sem comentários:
Enviar um comentário