FUNÇÕES QUÍMICAS INORGÂNICAS
São grupos de substâncias com propriedades
químicas semelhantes.
Ex.: Ácidos (O ácido ascórbico ( Vit. C )) , bases, sais, óxidos,
hidretos e carbetos .
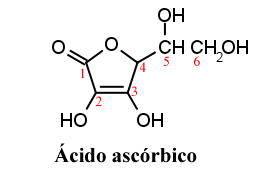

Fonte: http://www.brasilescola.com/http://acquisto.acquea.com/
ANTES DE ESTUDARMOS AS FUNÇÕES, DEVEMOS CONHECER ALGUNS
CONCEITOS BÁSICOS
A – DISSOCIAÇÃO IÔNICA
É a separação dos íons existentes
numa substância iônica quando esta entra em contato com a água ou com um
solvente ionizante.
#
Note que a água não atua como reagente.
B
– IONIZAÇÃO
É a formação de íons que ocorre através da
reação da água com uma substância molecular.
Ex.:
É o caso que ocorre nos ácidos, como veremos a seguir.
#
Note que a água atua como reagente
C
– GRAU DE IONIZAÇÃO (a)
Serve para medir a extensão da ionização. O grau varia entre 0 ou 0% e 1 ou 100%.

D – ELETRÓLITOS
Ex.: Solução aquosa de NaCl FONTE:http://pt.slideshare.net/
D.1 – ELETRÓLITO FRACO
É toda
substância que está pouco ionizada.
Ex.: HF (em 100 moléculas apenas 8 se ionizam).
a = 8 = 0,08 ou 8%
100
A lâmpada acenderá
pois a solução cotém pouquíssimos íons , e o brilho será pouco intenso.
D.2 – ELETRÓLITO FORTE
É toda
substância que está bastante ionizada.
Ex.: HCl a = 92 = 0,92 ou 92%
100
·Um átomo de
Hidrogênio só é ionizável (num ácido) quando estabelece ligação covalente suficientemente
polar.
ESTUDO DOS ÁCIDOS
São compostos moleculares que, em presença de água
produzem o íon hidroxônio (H3O+) ou hidrônio (Conceito de
Arrhenius).
Fonte: www.globalwarmingart.com
ou eletronicamente
ou estruturalmente
ou
H2O
ou
A equação final (a soma das 2
etapas)
__________________________________________________
 2H3O+ + SO4 – 2
2H3O+ + SO4 – 2 Note o corte do íon HSO4 –
Note o corte dos íons H2PO4 – 1 HPO4 – 2
CLASSIFICAÇÃO
DOS ÁCIDOS
A – DE ACORDO COM O N.º DE HIDROGÊNIO IONIZÁVEIS
A1 – Monoácido ou monoprotômicos –
quando apenas 1
H+ é produzido. Ex: HNO3, HI, HCl, HF... HCN
A2 – Diácido ou diprotômico – quando são
produzidos 2
hidrogênios ionizáveis. Ex.: H2SO4,
H2CO3, H2SO3, H2Cr2O7,
H2S.
Obs.: O H3PO3 e o H3PO2 são diácidos (observe na fórmula
estrutural).
A3– Triácido ou triprotômico – quando
são produzidos 3 hidrogênios ionizáveis. Ex.: H3PO4, H3BO3,
H3Fe(CN)6
A4 – Tetrácido ou tetraprotômico – quando são produzidos 4 hidrogênios ionizáveis. Ex.: H4P2O7, H4SiO4, H4Fe(CN)6
B – DE ACORDO COM A PRESENÇA DE OXIGÊNIO NA MOLÉCULA
B1
– Hidrácidos – não contêm oxigênio na molécula.
Ex.: HCl, HI, H2S, HF...
Obs.: Todos os hidrogênios da molécula
são ionizáveis.
B2 – Oxiácidos – contêm oxigênio na
molécula.
Ex.: H2SO4, HNO3, H3AsO3,
H3AsO4
Obs.: Somente são ionizáveis os
hidrogênios ligados
a átomos de oxigênio.
C – DE ACORDO COM O GRAU DE
IONIZAÇÃO

C1 – Ácidos Fortes – quando o grau de
ionização é maior do que 50%.
Ex.: HCl, H2SO4,
HCl O4, HNO3, HBr...
C2 – Ácidos Moderados – quando o número
de moléculas ionizadas ficam compreendidas entre 5 e 50%.
Ex.: HF, H3PO4, H2SO3,
HCl O2, ...
C3 – Ácidos Fracos – quando o grau de
ionização é abaixo de 5%.
Ex.: HCN, H2S, H3BO3,
...
FORÇA DE
UM OXIÁCIDO 
É
proporcional à diferença do número de átomos de oxigênio e o número de átomos
de hidrogênio na molécula.
Exceto
os H2CO3 e H3CCOOH (vinagre) de Delta = 1, mas são fracos.
D – DE ACORDO COM A
VOLATILIDADE
D1
– Ácidos Fixos – São sólidos com ligações pouco voláteis (alto ponto de ebulição). Ex.: H2C2O4(S),
H2SO4(L)
D2 – Ácidos Voláteis – São líquidos
voláteis (baixo ponto de ebulição) ou gases. Ex.: HNO3(L),
HCl, H2S, HCN(G)
E – NÚMERO DE ELEMENTOS NA
MOLÉCULA
E1 – Ácidos Binários: possuem apenas dois tipos de elementos.
Ex.: HBr, HCl, H2Se
E2 – Ácidos Ternários: possuem apenas três tipos de elementos.
Ex.: HNO2, HClO3, H2SO4
Ex.: H4Fe(CN)6,
H3Fe(CN)6, HSCN
Obs.: Existem ácidos com mais de quatro
elementos, mas que não serão fonte de nossos estudos.
FORMULAÇÃO
DOS ÁCIDOS

NOMENCLATURA DOS ÁCIDOS
A –
NOMENCLATURA DOS HIDRÁCIDOS
Os ácidos não oxigenadas
têm nomes terminados em ÍDRICOS. Seus
ânions, que resultam da ionização, têm nomes terminados em ETO.
|
Os
demais exemplos são:
a)
HI – ácido
iodídrico.
b)
HBr – ácido
bromídrico.
c)
HCN – ácido
cianídrico.
d)
HSCN – ácido
tiocianídrico.
e)
HNC – ácido
isocianídrico.
f) H3Fe(CN)6
– ácido ferricianídrico.
g) H4Fe(CN)6
– ácido ferrocianídrico.
h) HNC - Ácido isocianídrico
i ) HCl - Ácido Clorídrico.
OUTRA NOMENCLATURA
(NO CASO DOS GASES)
NOME DO ÂNION (ETO) + DE
HIDROGÊNIO
HCl – Cloreto de hidrogênio
HBr – Brometo de hidrogênio
HF – Flureto de hidrogênio
H2S – Sulfeto de
hidrogênio
HCN – Cianeto de hidrogênio
Estes gases só são chamados
de ácidos quando dissolvidos em água.
B – NOMENCLATURA DOS
OXIÁCIDOS
Os oxigenados têm nomes terminados em ICO.
Quando o elemento central formar apenas um ácido.
Exs.: H2CO3 - Ácido Carbônico
H3BO3 - Ácido Bórico
DICA: Outra maneira de se dar nomenclatura seria pela variação do número de átomos de oxigênio a um ácido padrão.
O padrão terá terminação “ICO”.
Exs.: H2CO3
(carbônico), H3PO4 (fosfórico), HNO3 (nítrico),
H2SO4 (sulfúrico) e HClO3 (clórico).
Adicionando um oxigênio ao padrão, este recebe o
prefixo “PER”.
Exs.: HMnO3 (mangânico) e HMnO4 (permangânico).
Retirando um oxigênio do padrão, este muda apenas de
sufixo, passando de “ICO” para “OSO”.
Exs.: HMnO3 (mangânico) e HMnO2 (manganoso).
Retirando dois oxigênios do padrão, além da mudança
citada acima, acrescenta-se o prefixo “HIPO”.
Exs.: HMnO3 (mangânico) e HMnO (hipomanganoso).
Veja a tabela
4A
|
5A
|
6A
|
7A
|
|
HClO4
|
||||
H2CO3
|
H3PO4
|
H2SO4
|
HClO3
|
Ácidos padrões
|
H3PO3
|
H2SO3
|
HClO2
|
||
HClO
|
ÁCIDO ORTO, META E PIRO
Esta
nomenclatura é usada para medir o grau de hidratação dos ácidos. Quando o
elemento central formar ácidos diferentes, com mesmo NOX, usam-se os prefixos
ORTO, META e PIRO, que diferem no grau de hidratação.
Obs.: Você notou que todos os exemplos têm o mesmo número
de oxidação? No caso (nox = + 5), portanto, esta nomenclatura só será válida
para ácidos diferentes com mesmo nox no elemento central.
Daí:
ORTO - Maior grau de hidratação.
META - Ácido obtido pela
retirada de 1 molécula de
água, de uma molécula do
ácido ORTO.
O ácido Metafosfórico é o HPO3
PIRO - Ácido obtido por 2 moléculas de ORTO, pela retirada de
1 de água.
PROPRIEDADE DOS ÁCIDOS
1.
Conduzem corrente
elétrica em solução aquosa.
3.
Possuem sabor
azedo. Ex.: O do limão.
4.
Os ácidos menos de
7 átomos em sua molécula são voláteis.
5.
Mudam a cor dos
indicadores:
· Fenolftaleína – vermelho para incolor
· Papel de Tornassol – azul para vermelho
· Metilorange – amarelo para vermelho
PRINCIPAIS ÁCIDOS E
SUAS UTILIDADES
®
H2SO4 – É o ácido encontrado nas baterias de automóveis,
sendo considerado o grande vilão da chuva ácida em regiões industrializadas.
Fonte:http://www.uems.br/
®
HF – É utilizado para atacar o vidro e em Gel para
condicionamento ácido de restaurações de porcelanas e resinas ; essencial para
o preparo destas peças objetivando ter uma cimentação adesiva. Também no
tratamento da água potável.
HNO3 – É o
ácido utilizado na fabricação de explosivos e fertilizantes nitrogenados.Também
está presente na chuva ácida
H3PO4 – É usado como
acidulante (realça o sabor doce) nos refrigerantes. Também é usado na
fabricação de fertilizantes.
H2CO3 – É encontrado nas bebidas gaseificadas e na
chuva ácida.Também presente na chuva ácida , porém é o menos agressivo.
CH3COOH – Conhecido como acético, é
o popular vinagre. Muito usado como tempero em saladas. Mas cuidado ! Não deve ser ingerido em jejum, nem usado em regimes de emagrecimento.
HCN – Famoso por ser utilizado nas câmeras da
morte. era originalmente um produto usado na agricultura.
HF – É utilizado para atacar o vidro e em Gel para
condicionamento ácido de restaurações de porcelanas e resinas ; essencial para
o preparo destas peças objetivando ter uma cimentação adesiva. Também no
tratamento da água potável.
HCl – Conhecido comercialmente
como muriático, é encontrado no suco gástrico e é muito usado na limpeza de
pisos, pias latrinas e fungos.
H2S – No
estado gasoso, muito conhecido pelo seu odor característico de ovo podre. É altamante tóxico !

Fonte:http://obutecodanet.ig.com.br/
H3BO3
– Muito usado em colírios, É freqüentemente utilizado como insecticida relativamente atóxico, para matar baratas, cupins, formigas, pulgas e muitos outros insetos. Pode ser utilizado
diretamente sob a forma de pó em pulgas, misturando-o com açucar de confeiteiro
como atrativo para as formigas e baratas.
BOM PROVEITO ! AGORA EXERCITE !


















Sem comentários:
Enviar um comentário