® É um número que indica a variação da
quantidade de elétrons que foram cedidos ou recebidos por átomos, moléculas ou
íons, num processo químico.
PRIMEIROS
CONCEITOS
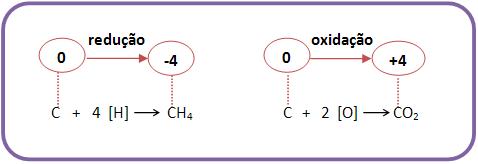

OXIDAÇÃO
®
É a reação com o oxigênio (ocorre adição de oxigênio).
2Mg + O2 ® 2MgO
REDUÇÃO
®
É a diminuição da quantidade de oxigênio.
Ni2O3 + C ® 2NiO + CO
OBS: Tanto a
oxidação, quanto a redução ocorrem sem a presença do oxigênio
obrigatoriamente. Isto se deve às
semelhanças eletrônicas, daí os conceitos atuais terem sido ampliados, ou seja:
OXIDAÇÃO – É perda de elétrons
Zn0 ® Zn++
+ 2e-
REDUÇÃO – É o ganho de elétrons
Cu++ + 2e-
® Cu0
® A
oxidação e a redução são fenômenos que ocorrem ao mesmo tempo
(simultâneos). Esses processos
(transferência de e-) são denominados de reação de OXIRREDUÇÃO,
OXIDAÇÃO-REDUÇÃO, OXI-RED OU REDOX.
OXIDANTE E
REDUTOR
OXIDANTE ® É o elemento ou substância que
provoca a oxidação de outro elemento ou substância, sofrendo assim, uma
redução.
Ex.: NiBr2 + Br ® NiBr3
REDUTOR ® É o
elemento ou substância que provoca a redução de outro, sofrendo assim uma oxidação
Estes processos acima definidos ocorrem em reações químicas tais como:
Estes processos acima definidos ocorrem em reações químicas tais como:
NOX (NÚMERO
DE OXIDAÇÃO)
NOX EM UM COMPOSTO IÔNICO
® O nox de um elemento num composto iônico é a
própria carga de seu íon (Valência).
Na ® +1 Na+Cl –
Cl ® –1
+ 1 – 1 = 0
Ex2.:
CaBr2 ® Ca ® +2 Ca+2 Br –
Br ® –1 + 2
– 2 = 0
OBS.: A soma do NOX de todos os átomos num composto
é zero.
NOX EM UM COMPOSTO COVALENTE
® É a carga que o elemento receberia se houvesse
completa separação dos átomos de molécula.
HCl Þ H – Cl H
® + 1
(polar) Cl ® – 1
S ® +4
SO2
Þ O = S ® O
O ® -2
NOX EM UMA SUBSTÂNCIA SIMPLES
® É sempre igual a zero, pois não há diferença
de eletronegatividade (moléculas apolares e substâncias simples metálicas).
Nox
H2 Þ {H ® O
Nox
Sódio ® Na2O ® {Na Þ O
Nox
Ferro ® FeO ® {Fe Þ O
NOX EM UM
ÍON
®
É a própria carga de íon.
Al +3 ® NOX = +3
íons simples O –
2 ® NOX = –2
Ca+2 ® NOX = +2
SO4– 2 ® NOX = –2
íons compostos
NO3–
® NOX = –1
S O4 N O3
¯ ¯ ¯ ¯
S
[+ 6 (6A).1] + [– 2.4] = S [+ 5.1] + [–
2.3] =
S
6 + (– 8) = – 2 S 5 + (– 6) = – 1
SO4– 2 NO3–
1
DETERMINAÇÃO DO NÚMERO DE OXIDAÇÃO
REGRAS
PRÁTICAS
A – HIDROGÊNIO (exceto nos
hidretos metálicos) Þ NOX = + 1 nos hidretos (NaH, CaH2,...)
Þ NOX = – 1
B – SUBSTÂNCIAS SIMPLES (Ca, C, H2,
N2..) Þ
NOX = 0
C – OXIGÊNIO (exceto nos
peróxidos e superóxidos) Þ NOX = –2
· Nos
peróxidos ®
NOX = – 1 (devido ao agrupamento O2-2)
· Nos
superóxidos ®
NOX = – ½ (devido ao agrupamento O4-2)
D – METAIS ALCALINOS (Li, Na, K,
Rb, Fr, Cs) e a Prata (Ag) Þ NOX = +1
E – METAIS ALCALINOS TERROSOS (Be, Mg,
Ca, Sr, Ba, Ra) e o Zinco (Zn) Þ NOX = +2
F – ALUMÍNIO Þ NOX = +3
G – A soma do NOX sempre é igual a zero.
H – A soma do NOX num íon composto é
sempre igual à carga do íon.
I – O NOX depende da coluna onde estão
situados os elementos (família A).
DICAS PARA
DESCOBRIR QUEM SE OXIDA OU QUEM SE REDUZ
I. O elemento
entrar só e sai acompanhado;
II. O elemento
mudar de lugar;
III. A presença
da água oxigenada (o oxigênio dela é – 1);
IV. Entrar íon e
sair substância ou vice-versa;
V. O mesmo par
de elementos com alteração em suas quantidades.
Tipo: SO4–2
e SO3–2
VI. Se os
números matematicamente aumentam ocorre oxidação.
VII. Se os números matematicamente diminuem ocorre
redução.




Pelo Professor Eudo Robson



Sem comentários:
Enviar um comentário