ÁTOMOS ISÓTOPOS
- São átomos que pertencem ao mesmo
elemento químico que apresentam massas diferentes.
Ex.: 17Cl35 e 17Cl37/1H1
,1H2 e 1H3 /6C12,
6C13 e 6C14/ 19K39
,19K40 e 19K41
* Nos átomos de
hidrogênio temos o Monotério (1H1), Deutério (1H2)
e o tritério (1H3).
ÁTOMOS ISÓBAROS
- São átomos de elementos químicos
diferentes, que possuem o mesmo número de massa.
Ex.: 18Ar40 e 19K40/
20Ca42, 21Sc42 e 22Ti42/
26Fe57 e 27Co57/ 19K40
e 20Ca40
ÁTOMOS ISÓTONOS
- São átomos de diferentes elementos
químicos, com mesmo número de nêutrons.
Ex.: 22Ti50 e 26Fe54/
19K39 e 20Ca40
ÁTOMOS, ÍONS E ESPÉCIES ISOELETRÔNICOS
- São os átomos e íons que possuem o
mesmo número de elétrons.
Ex.: 8O–2, 9F–1 e 12Mg+2/ MgH2, NO+1 e 14Si, 11Na+1/ 8O–2 e 10Ne20
- Como já sabemos, substâncias são diversos tipos de
matéria e podem se classificar em:
I - SUBSTÂNCIA SIMPLES
- É aquela
formada por átomos do mesmo elemento químico, ou seja, átomos iguais.
Ex.: O2, H2, He, Fe, Cl2,
Al, O3, P4,S8...
II – SUBSTÂNCIA COMPOSTA
- É aquela
formada por átomos de elementos químicos diferentes.
Ex.: NaCl, HBr, KOH, CaO, H2O, FeCl3,
C6H12O6, KMnO4, Na4[Fe(CN)6]...
III - SUBSTÂNCIA PURA
- É a
substância simples ou composta, formada por moléculas quimicamente iguais entre
si. Possui propriedades bem definidas tais como: ponto de fusão, ponto de
ebulição, etc. Dificilmente são encontradas na natureza, sendo em geral
produzidas em laboratório. Abaixo, observamos os gráficos do aquecimento e do
resfriamento de uma substância pura.
Ex.: H2O, KI, NaCl, CO2, KmnO4,
C12H22O11 ...
GRÁFICOS DE AQUECIMENTO E RESFRIAMENTO
As substâncias
ainda são classificadas de acordo com o número de átomos. Sendo assim elas
podem ser:
A- Monoatômicas - quando são formadas por um só
átomo,
Ex.: He, S, Ne,
Fe, Ar, ...
B - Diatômicas
- quando são formadas por dois átomos.
Ex.: H2, O2, Cl2,
HBr, HI, NaCl, NaI...
C - Triatômicas
- quando são formadas por três átomos.
Ex.: H2O,
NaOH, CO2, SO2, O3, HMnO, HIO, NaIO ...
D - Tetratômicas
- quando são formadas por quatro átomos.
Ex.: NH3,
AlCl3, NiBr3, HClO2, P4,
KIO2 ...
E - Pentatômicas
- quando são formadas por cinco átomos.
Ex.: CH4, CCl4, CBr4,
KMnO3, KIO3 ...
COMBINAÇÃO
- É a reunião de duas ou mais substâncias que perdem suas
propriedades características, para formar uma outra substância com propriedades
e características diferentes das anteriores. A combinação é um fenômeno químico
com proporções constantes, tendo, portanto, fórmula.
Ex.:
H2 + ½ O2 --------- H2O. (A formação da água)
2 Al + 3 Cl2 --------- 2 AlCl3. (A
formação de cloreto de alumínio)
C + O2 --------- CO2 (A formação do gás
carbônico)
CO2 + H2O ---------- H2CO3
(A formação do ácido carbônico)
ALOTROPIA
- É a formação de duas ou mais substâncias diferentes pelos átomos
do mesmo elemento químico.
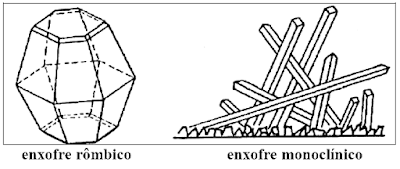
Ex.: o enxofre rômbico e o enxofre monoclínico (diferem de volume,
densidade e ponto de fusão), o carbono grafite e o carbono diamante (diferem na
arrumação dos átomos, condução de corrente elétrica, dureza), o fósforo
vermelho e fósforo branco (o vermelho não é tóxico), e o oxigênio, que difere
na atomicidade, gerando o ozônio (O3) e o gás oxigênio (O2)
propriamente dito.
a) O caso do enxofre
O enxofre apresenta três formas alotrópicas, todas com
atomicidade 8. Elas são:
a.1 - enxofre rômbico
a.2 - enxofre monoclínico
a.3 - enxofre amorfo.
Os dois primeiros são formados por cristais e o último,
não. Eles diferem quanto a estrutura, ou seja, a arrumação entre seus átomos.
b) O caso do fósforo
O fósforo apresenta basicamente
dois estados alotrópicos, diferenciando entre si pelo número de átomos (atomícidade
– tamanho da cadeia).
b.1 - O Fósforo branco é
formado por molécula tetraédrica sendo bastante tóxico.
b.2 - O fósforo vermelho é
formado por cadeias de tetraedros sendo não tóxico.
c) O caso do carbono
O Carbono apresenta basicamente
três estados alotrópicos, diferenciando entre si pela arrumação dos átomos (estrutural).
C.1 - Na grafita (ou grafite), os átomos de carbono formam planos paralelos entre si. É um corpo
amorfo, mole e bom condutor de eletricidade.
C.2 - No diamante, os átomos formam uma estrutura mais
compacta. Seus átomos se unem numa estrutura cristalina má condutora de
eletricidade e dura.
OBS: Existe ainda o caso do fulereno ou futeboleno.
- Até 1985, as únicas formas conhecidas do carbono eram estas
duas: grafite e diamante. Naquele ano, um grupo de cientistas que estava de
olho no espaço pesquisando estrelas vermelhas, um tipo formado essencialmente
por carbono. Descobriu que os átomos de carbono podiam se organizar de uma
maneira diferente, que não resultava nem no grafite nem no diamante. Essas
novas formas de carbono foram chamadas fulerenos.
O nome esquisito surgiu mais ou menos assim: um dos cientistas que
participou da descoberta gostava muito das obras em estilo geométrico de um
famoso arquiteto, chamado Richard Buckminster Fuller, e quis homenageá-lo. Daí
o nome em inglês fullerene colou, mesmo sob os protestos de outros cientistas
que queriam que as novas formas de carbono fossem chamadas de... futebolenos! Veja a figura e entenda por quê!
d) O
caso do oxigênio
- O oxigênio apresenta
basicamente dois estados alotrópicos, diferenciando entre si pelo número de
átomos que formam a molécula.
d.1 - Existe o gás oxigênio (O2) que
é uma molécula diatômoca. O oxigênio é uma molécula mais estável que a molécula
do ozônio. É um gás incolor e inodoro.
d.2 – temos o gás ozônio (O3) que é uma molécula triatômica. É a camada
de ozônio protege a terra contra os raios ultravioletas. É um gás azul claro de
cheiro irritante sendo usado como bactericida.
SOLUÇÕES E SUSPENSÕES
As misturas homogêneas são chamadas também de soluções, e
apresentam apenas uma fase.
Ex.: soro
fisiológico, água do mar ou um refrigerante sem gás, água mineral, álcool
caseiro, acetona de farmácia, ar despoluído, colírios etc ...
- As misturas heterogêneas são denominadas de suspensões, e
apresentam mais de uma fase.
Ex.:
ar poluído, água da praia, leite, iogurte, sangue, espumas, etc ...
DISSOLUÇÃO
- É o fenômeno físico no qual uma substância se mistura com outra,
dando origem a uma solução.
Ex.: a preparação do soro caseiro, a fabricação de
refrigerantes, sucos, do nosso café solúvel de todos os dias.
SOLVENTE E SOLUTO
- Para definirmos melhor,
vamos tomar como exemplo a preparação de uma solução com um copo de água e uma
colher de sal. A água dissolverá o sal, portanto será o solvente. O sal será
dissolvido pela água, por consequência será o soluto. De acordo com a
quantidade de soluto dissolvido, as soluções podem ser:
A - SOLUÇÃO DILUÍDA
- É
aquela que contém pouca quantidade de soluto, ou seja, o soluto não atinge o
coeficiente de solubilidade da solução. Ex.: 10g de sal num litro de água,
colírios, soro fisiológico, água de piscina, álcool 20% (caseiro), vinagre ...
B - SOLUÇÃO CONCENTRADA
- É aquela que contém grande quantidade de soluto, sem que se
esgote a capacidade de dissolução do solvente. Neste caso, o coeficiente de
solubilidade não foi atingido.
Ex.:
sucos desidratados (Concentrados) para preparo, 300g de sal num litro de água.
C - SOLUÇÃO SATURADA
- É aquela que contém uma quantidade tão grande de soluto
dissolvido, que a capacidade de dissolução do solvente esgota-se. Neste caso, o
coeficiente de solubilidade foi atingido.
Ex.:
no caso da solução concentrada, continuamos a adicionar colheres de sal.
Chegará a um ponto que a água não conseguirá mais dissolver o sal. A água do
mar é um exemplo natural dessa solução.
C - SOLUÇÃO SUPERSATURADA
- É aquela que depois de saturada, é aquecida, para provocar novas
brechas entre as moléculas que estando em movimento aceitam novas partículas de
soluto.
Ex: É a produção do gelo instantâneo. (blog
universechemistry.blogspot.com)
Como
vemos na figura ao lado, após aquecida, a solução (água + acetato de sódio) que
é altamente instável, é resfriada, e recebe o GÉRMEM DE CRISTALIZAÇÃO, que
é a menor porção de soluto capaz de precipitar todo excesso de soluto
dissolvido.
CONCENTRAÇÃO DE UMA SOLUÇÃO (C)
- É o quociente entre a massa do soluto,
em gramas, e o volume da solução, em litros,
onde: C - concentração, m1
- massa do soluto, V - volume da solução.
Ex1:
Qual a concentração de uma solução, onde são adicionados 1 kg de NaCl em 500 cm3
de água?
C
= ?
M1
= 1 kg = 1.000 g
V
= 500 cm3 = 0,5 L
Ex2:
Qual a massa de NaCl que deve ser adicionada a 1000 dm3 de água,
para que essa solução tenha uma concentração de 12 g/L?
m1
= ?
V
= 1.000 dm3 = 1.000L
Pelo Professor Eudo Robson
























Sem comentários:
Enviar um comentário