INTRODUÇÃO
Quando
adicionamos um soluto não volátil a um líquido puro, algumas propriedades desse
líquido sofrem modificações tais como: abaixamento da pressão máxima de vapor, abaixamento
da temperatura de congelação e um fenômeno chamado pressão osmótica.
Essas modificações ou efeitos são chamados de propriedades coligativas.
OBS:
Os efeitos coligativos dependem exclusivamente do número de partículas
dispersas.
CÁLCULO DO NÚMERO DE PARTÍCULAS DISSOLVIDAS
Existem
2 tipos de cálculos: um para as soluções iônicas, outro para as soluções
moleculares. Numa solução molecular o cálculo é feito a partir do número de
moles do soluto.
Ex: Qual o número de partículas
dissolvidas numa solução aquosa contendo 34,2 gramas de sacarose
(C12H22O11) ? mol = 342
1 mol ____________ 6,02 x 1023
0,1 mol ___________ x
x = 6,02 x 1022 partículas
Ex2: No preparo de 200 mL de
uma solução aquosa 0,4 molar, foi adicionado uma certa massa de glicose (C6H12O6).
Qual o nº de partículas dissolvidas
1 mol ____________ 6,02 x 1023
0,08 _____________ x
x = 4,82 x 1022
moléculas
* Numa solução iônica, deve ser observado
o fenômeno da ionização, levando em conta o número de íons dissolvidos e o
número de moléculas não-ionizadas. Para isso devemos conhecer o fator VAN’T
HOFF.
FATOR DE VAN’T HOFF ( i )
FONTES: LE PRIX NOBEL E WIKIPÉDIA
É o
fator que depende do grau de ionização.
Lembrando
que:
Onde:
np = n.º de partículas.
Obs.:
Portanto, o fator de Van’t Hoff depende de ALFA e i.
EXEMPLOS
Ex1: Qual é o fator de Van’
T Hoff numa solução aquosa
de HF, sabendo que µ = 80 % ?
HF ________ H+ + F-
1 molécula 1 cátion 1 ânion
1 molécula _________________________ gerou 2 íons
tomando 100 moléculas como base de
cálculo, teremos:
HF __________________ H+ + F
-
dissolvem-se 100 0 0
ionizam-se 80 0 0
formam-se 0 80 80
sobraram 20 80 80
ou
seja, 20 moléculas não ionizaram e formaram-se 80 cátions e 80 ânions. Total
das partículas 180.
I = 180:100 = 1,8
Agora,
para calcularmos o número de partículas dissolvidas numa solução iônica, basta
multiplicarmos o fator pelo número de moles e pelo número de Avogadro.
PELO PROFESSOR EUDO
ROBSON
O RESTO DA AULA ESTÁ
DISPONÍVEL EM PDF PARA
DOWNLOAD GRATUITO NO SITE:






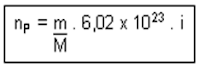
Sem comentários:
Enviar um comentário