FENÔMENO
- É qualquer fato (acontecimento) que ocorre na natureza.
Ex: uma pessoa andando, a chuva e, uma folha caindo, o automóvel parando, uma explosão...
Os fenômenos podem ser:
A - FÍSICO – É aquele que não altera a estrutura da matéria.
Ex: a água se transformando em vapor, gelo derretendo, o fenômeno da chuva, um carro freando, um gêiser, triturar um sólido, mexer uma solução pastosa, etc ...
B - QUÍMICO – É aquele que altera a estrutura da matéria.
Ex: a combustão da madeira, do papel e do álcool, fermentação das uvas na fabricação do vinho, fermentação da massa do pão, efervescência do comprimido de vitamina C, etc ...
C - BIOLÓGICO – Antes de tudo é um fenômeno químico que diz respeito à vida.
Ex: fecundação, digestão, a putrefação dos corpos, etc...
CONCEITOS IMPORTANTES
CORPOS AMORFOS – São aqueles cujas partículas se agrupam de maneira desorganizadas, não formando assim arranjo especial. Ex: madeira, porcelana, cera, piche de asfalto,
CORPOS CRISTALINOS – São aqueles que se agrupam de forma ordenada formando arranjos especiais. Os corpos cristalinos assumem formas de cubos, prismas, tetraedros. Ex: açúcar, gelo, sal, diamante, quartzo, ...
FORÇAS DE COESÃO – São aquelas que tendem aproximar as partículas entre si. Exemplo: os polos opostos de um imã ao se aproximarem.
FORÇAS DE REPULSÃO – São aquelas que tendem afastar as partículas entre si. Exemplo: os pólos iguais de um imã ao se aproximarem.
ESTADOS FÍSICOS DA MATÉRIA (OU
FASES DE AGREGAÇÃO DA MATÉRIA)
São quatro os estados físicos da matéria:
ESTADO SÓLIDO - Apresenta forma e volume constantes. Nele, as forças de coesão são maiores do que as de repulsão.
ESTADO LÍQUIDO - Apresenta forma variável e volume constante. Nele, as forças de coesão são iguais às de repulsão.
ESTADO GASOSO - Apresenta forma e volume variáveis. Nele, as forças de repulsão são maiores do que as de coesão.
ESTADO PLASMA - Chama-se plasma a um gás completamente ionizado, que a uma temperatura muito elevada é composto essencialmente por elétrons e núcleos atômicos livres. Ao plasma chama-se o quarto estado físico da matéria.
Atualmente são conhecidos seis (6) fases da matéria, sendo três ordinárias: fase sólida, fase líquida e fase gasosa, uma fase menos conhecida apesar de ser a mais abundante do universo, a fase de plasma.
As outras duas foram obtidas em laboratório, que são o condensado de Bose- Einstein e o condensado de Fermi-Dirac.
Até o momento esses dois últimos não estão sendo usados para coisas práticas do dia a dia. Já o plasma tem grande aplicação tanto como entretenimento, como na bola de plasma da foto, quanto nas telas de plasma para tv.
O plasma tem também aplicações industriais em maçaricos e fornos especiais, em pesquisa científica nos aceleradores de partículas e pesquisa sobre fusão nuclear.
CURIOSIDADE: nos líquidos observamos um fenômeno, ao qual denominamos "TENSÃO SUPERFICIAL".
Na figura observamos que as partículas da parte superior do líquido distribuem suas forças com um número menor de partículas, do que as que estão no interior do líquido.
Por isso, as forças distribuídas na superfície são maiores do que as do interior do líquido. Isto faz com que insetos consigam caminhar sobre a superfície dos líquidos. É também responsável pela formação das bolhas de sabão dentre outras coisas.
MUDANÇAS DE ESTADO FÍSICO
- As substâncias (diversos tipos de matéria) podem passar de um estado para outro. Nessa passagem, a temperatura e a pressão atmosférica são fatores muito importantes. É importante salientar que, quanto maior a altitude, menor a pressão atmosférica.
OBS 1: Os fenômenos que ocorrem para a direita do gráfico, o fazem com AUMENTO DE TEMPERATURA (PROCESSOS ENDOTÉRMICOS) E ABSORÇÃO DE CALOR .
OBS 2: Os fenômenos que ocorrem para a esquerda do gráfico, o fazem com DIMINUIÇÃO DA TEMPERATURA (PROCESSOS EXOTÉRMICOS) E LIBERAÇÃO DE CALOR
A – SUBLIMAÇÃO OU RESSUBLIMAÇÃO
- É a passagem direta do estado sólido para o estado gasoso e vice-versa.
Ex.: a naftalina dentro de um armário, a cânfora, gelo-seco (CO2 – gás carbônico), o iodo sólido apresenta-se como cristais pardos (marrons), quando aquecido sublima exalando vapores de cor violeta, ...
B – FUSÃO
É a passagem do estado sólido para o estado líquido.
Ex.: o gelo derretendo, o ferro sendo fundido.
* A fusão possui três leis:
1.ª LEI - Durante a fusão, a temperatura permanece constante.
Ex: Quando a água sólida (gelo) começa a derreter (fundir), a temperatura do sólido não sairá de 0°C (temperatura de fusão da água) até que todo ele se derreta e se transforme em água líquida novamente.
2.ª LEI - As substâncias se fundem sempre à mesma temperatura, sob determinada pressão.
Ex: a água derrete a 0° C em qualquer parte do mundo, desde que esteja na altitude do nível do mar.
3.ª LEI - Durante a fusão, as substâncias aumentam de volume, com exceção do gelo, ferro e a prata. Esta lei será melhor entendida no estudo da física do 2º grau.
Obs.: De um modo geral, quanto maior a pressão que exercemos sobre um sólido, mais alto se tornará seu ponto de fusão. Algumas poucas substâncias têm seu ponto de fusão abaixado com o aumento da pressão, como o gelo, por exemplo.
TIPOS DE FUSÃO
B. 1 – FUSÃO CRISTALINA
Ocorre quando uma substância sólida passa diretamente para o estado líquido.
Ex: gelo → água.
B.2 – FUSÃO PASTOSA
Ocorre quando uma substância sólida se transforma em pasta, antes de se transformar em líquido. Ex.: cera, manteiga e vidro.
C – VAPORIZAÇÃO
É a passagem do estado líquido para o estado gasoso. A vaporização está dividida em: evaporação, ebulição e calefação.
C.1 – EVAPORAÇÃO
- É a passagem que se dá de forma espontânea e lenta. Na evaporação são importantes a temperatura, a ventilação, a superfície e as características do líquido. Vejamos cada um.
TEMPERATURA - Quanto maior a temperatura, mais rápida a evaporação.
Ex: nos dias quentes as roupas secam com maior rapidez.
VENTILAÇÃO - Quanto maior a ventilação, mais rápida a evaporação.
Ex: nos dias quentes em que há muito vento, as roupas secam com maior rapidez.
SUPERFÍCIE - Quanto maior a superfície, maior a evaporação.
Ex: se colocarmos um lençol e um lenço para secar, o que vai evaporar maior quantidade de água será o de maior superfície, ou seja o lençol.
CARACTERÍSTICAS DO LÍQUIDO – Em geral quanto mais denso for o líquido, mais rápida será a sua evaporação.
Ex: se colocarmos um copo de óleo e outro de água no sol, a água evaporará primeiro.
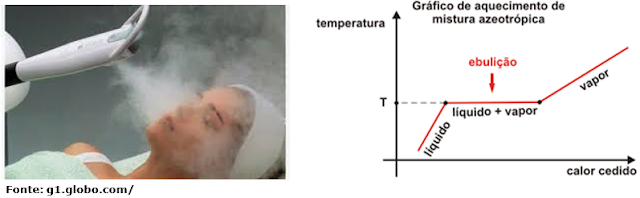
C.2 – EBULIÇÃO
- É a passagem do estado líquido para o estado gasoso, que se faz de maneira induzida. Esta passagem ocorre de uma forma rápida e é regida por duas leis.
1.ª LEI - As substâncias puras entram em ebulição sempre à mesma temperatura, desde que não haja variação de pressão atmosférica. Ex: a água ferverá a 100 ° C em qualquer parte do mundo, desde que esteja na altitude do nível do mar.
2.ª LEI - Durante a ebulição, a temperatura permanece constante. Ex: a água permanecerá a 100° C enquanto estiver no estado líquido.
C.3 – CALEFAÇÃO
- É a passagem que se dá de forma brusca, podendo ser natural ou artificial. Ex.: uma gota de água caindo sobre uma chapa de metal quente.
D – CONDENSAÇÃO OU LIQUEFAÇÃO
- É a passagem do estado gasoso para o estado líquido.
Ex.: a água da chuva é proveniente da liquefação das nuvens, a água nos cascos de refrigerantes.
E – SOLIDIFICAÇÃO
- É a passagem do estado líquido para o estado sólido.
Ex.: a água se transformando em gelo.
OBS.: Em condições especiais, a maioria das substâncias pode passar do estado sólido para o líquido ou gasoso (vapor). Outras, entretanto, não mudam nunca de estado físico. Quando submetidas a elevadas temperaturas, incineram-se, isto é, viram cinzas, mas não mudam de estado.
Ex.: a madeira não tem ponto de fusão. Ela se carboniza (vira carvão).
CURIOSIDADE: Temperatura x Altitude (para água pura)
CURIOSIDADE 2:
Qual é a influência da temperatura na tensão superficial? Um aumento da temperatura acarreta uma redução da tensão superficial. A limpeza de superfícies e de tecidos, por exemplo, torna-se mais fácil quando é usada água quente, em virtude da redução de sua tensão superficial
Gás e Vapor
A diferença entre gás e vapor é dada a partir da temperatura crítica. O vapor é a matéria no estado gasoso, estado esse que pode ser liquefeito com o aumento da pressão. Com o gás não ocorre o mesmo. Ele é um fluido impossível de ser liquefeito com um simples aumento de pressão. Isso faz com o gás seja diferente do vapor.
PELO PROFESSOR EUDO ROBSON























Sem comentários:
Enviar um comentário