HIBRIDAÇÃO - SP1 – SP2 – SP3
HIBRIDAÇÃO SP1 (CASO DO BERÍLIO)
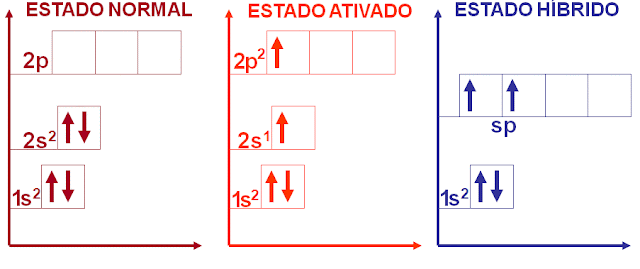
- Observe os três estados do Berílio. No estado normal, temos todos orbitais p vazios e os orbitais s, estão completos. Ao receber energia, o elétron do orbital s é promovido ao orbital p.
Neste momento, ocorre a fusão do orbital s, agora semipreenchido com um orbital p, formando o novo orbital sp1.
Isto significa que se abriu em p, com o elétron proveniente de s, mais um espaço para uma nova ligação.
Compare agora, no estado normal, nenhum local para ocorrer ligação, haja vista não haver elétrons desemparelhados de p.
Agora, no estado híbrido, temos dois locais para alojar elétrons, justamente no novo orbital híbrido, onde encontramos dois elétrons desemparelhados.
Representado as duas ligações temos:
- Devido a repulsão dos pares eletrônicos, todos os ângulos formados são iguais e de valor 180°. A geometria molécula é linear. Caso envolva o átomo de carbono obrigatoriamente teremos duas duplas ligações ou uma tripla e uma simples.
Ex: BeH2, BeF2, BeCI2, HCN, CO2...
HIBRIDAÇÃO SP2 (CASO DO BORO)
- Novamente observe os três estados, agora do Boro. No estado normal, temos um orbital p semipreenchido. Os orbitais s, estão completos. Ao receber energia, o elétron do orbital s é promovido ao orbital p.
Neste momento, ocorre a fusão do orbital s, agora semipreenchido com os orbitais p, formando o novo orbital sp2. Significa que se abriu em p, com o elétron proveniente de s, mais um espaço para uma nova ligação.
Compare, no estado normal, apenas um local para ocorrer ligação, justamente onde está o único elétron desemparelhado de p.
Agora, no estado híbrido, temos três locais para alojar elétrons, haja vista que temos três elétrons desemparelhados.
Representado as três ligações temos:
- Devido a repulsão dos pares eletrônicos, todos os ângulos formados são iguais e de valor 120°. A geometria molécula é trigonal. Caso envolva o átomo de carbono obrigatoriamente teremos uma dupla ligação e duas simples.
Ex: BH3, BF3, BCI3, CH2O ...
HIBRIDAÇÃO SP3 (CASO DO CARBONO)
- Novamente observe os três estados, agora do Carbono. No estado normal, temos dois orbitais p semipreenchidos. Os orbitais s, estão completos. Ao receber energia, o elétron do orbital s é promovido ao orbital p.
Neste momento, ocorre a fusão do orbital s, agora semipreenchido com os orbitais p, formando o novo orbital sp3. Significa que se abriu em p, com o elétron proveniente de s, mais um espaço para uma nova ligação.
Compare, no estado normal, apenas dois locais para ocorrer ligação, justamente onde estão os dois elétrons desemparelhados de p.
Agora, no estado híbrido, temos quatro locais para alojar elétrons, haja vista que temos quatro elétrons desemparelhados.
Representado as quatro ligações temos:
- Devido a repulsão dos pares eletrônicos, todos os ângulos formados são iguais e de valor 109°28’. A geometria molécula é tetraédrica.Todas as ligações átomo de carbono serão simples.
Ex: CH4, CF4, CCI4, ...
DICAS FINAIS APLICADAS PARA O CARBONO, QUE É
O OBJETO DE ESTUDO DA QUÍMICA ORGÂNICA.
I – Carbono com quatro ligações simples, hibridação sp3.
II – Carbono com três ligações sendo uma dupla, hibridação sp2.
III – Carbono com duas ligações (duas duplas ou uma tripla e uma simples), hibridação sp.
VEJA A TABELA ABAIXO
PELO PROFESSOR EUDO ROBSON
FONTE DOS TEXTOS
- PROFESSOR EUDO ROBSON.
FONTE DAS IMAGENS
- QUÍMICA A FAVOR DA VIDA







Sem comentários:
Enviar um comentário