01)
(PUC - SP-2002) Analise as propriedades físicas na
tabela abaixo:
Segundo os modelos de ligação química, A, B, C e D
podem ser classificados, respectivamente, como,
a) composto iônico, metal, substância molecular,
metal.
b) metal, composto iônico, composto iônico,
substância molecular.
c) composto iônico, substância molecular, metal,
metal.
d) substância molecular, composto iônico, composto
iônico, metal.
e) composto
iônico, substância molecular, metal, composto iônico.
02)
(PUC - SP-2000) Em 1916, G. N. Lewis publicou o
primeiro artigo propondo que átomos podem se ligar compartilhando elétrons.
Esse compartilhamento de elétrons é chamado, hoje, de ligação covalente. De
modo geral, podemos classificar as ligações entre átomos em três tipos
genéricos: ligação iônica, ligação metálica e ligação covalente.Assinale a
alternativa que apresenta substâncias que contêm apenas ligações covalentes.
a) H2O, C(diamante), Ag e LiH
b) O2, NaCl, NH3 e H2O
c) CO2, SO2 , H2O e
Na2O
d) C(diamante),
Cl2, NH3 e CO2
e) C(diamante), O2, Ag e KCl
03)
(PUCCamp-1998) Considere os seguintes compostos do
enxofre:
I. SO3 - um dos poluentes responsáveis
pela formação da "chuva ácida".
II. Na2SO4 - utilizado na
obtenção de papel sulfite.
III. ZnS - componentes da blenda, minério de zinco.
Em relação ao tipo de ligação química que essas
substâncias apresentam, é correto afirmar que:
A) são todas moleculares.
B) são todas iônicas.
C) I e II são moleculares e III é iônica.
D) I é iônica e II e III são moleculares.
E) I
é molecular e II e III são iônicas.
04)
(UEMG-2007) As propriedades exibidas por um certo
material podem ser explicadas pelo tipo de ligação química presente entre suas
unidades formadoras. Em uma análise laboratorial, um químico identificou para
um certo material as seguintes propriedades:
• Alta temperatura de fusão e ebulição
• Boa condutividade elétrica em solução aquosa
• Mau condutor de eletricidade no estado sólido
A partir das propriedades exibidas por esse
material,
assinale a alternativa que indica o tipo de ligação
predominante no mesmo:
a) metálica
b) covalente
c) dipolo induzido
d) iônica
05)
(UEMG-2008) Quase todos os metais da Tabela
Periódica podem ser encontrados em placas de circuito impresso que compõem
equipamentos eletroeletrônicos. Sobre os metais dessa tabela é CORRETO afirmar
que
a) formam ligações químicas covalentes com os
halogênios.
b) reagem com ácidos liberando dióxido de carbono.
c) são
constituídos por ligações entre íons e elétrons livres.
d) são depositados no anodo de uma cela
eletroquímica.
06)
(UERJ-1998) Apesar da posição contrária de alguns
ortodontistas, está sendo lançada no mercado internacional a "chupeta
anticárie". Ela contém flúor, um já consagrado agente anticárie, e
xylitol, um açúcar que não provoca cárie e estimula a sucção pelo bebê. Considerando
que o flúor utilizado para esse fim aparece na forma de fluoreto de sódio, a
ligação química existente entre o sódio e o flúor é denominada:
A) iônica
B) metálica
C) dipolo-dipolo
D) covalente apolar
07)
(UERJ-1998) O gosto amargo da cerveja é devido à
seguinte substância de fórmulas estrutural plana:
Essa substância, denominada mirceno, provém das
folhas de lúpulo adicionadas durante a fabricação da bebida. O número de
ligações pi presentes na estrutura do mirceno é igual a:
A) 3
B) 5
C) 8
D) 15
08)
(UFC-2003) Quando átomos são ionizados, suas propriedades são
alteradas drasticamente. Como xemplos, podemos relacionar:um agregado de
moléculas de bromo (Br2) possui coloração vermelha. Já os íons
brometos (Br–1), presentes nos cristais de brometo de sódio, NaBr,
são incolores;o sódio metálico (Na) reage violentamente com água (H2O),
enquanto os íons Na+1são estáveis em meio aquoso [Na+1(H2O)n];
moléculas de cloro (Cl2) constituem um gás venenoso de coloração
verde claro. Já os íons cloretos (Cl–1), presentes no sal de cozinha
(NaCl), são incolores e de baixíssima toxicidade. Assinale a alternativa
correta.
A) Os raios iônicos dos ânions são menores do que os
dos respectivos átomos neutros que os originam.
B) As
propriedades dos átomos e de seus íons de origem são fortemente dependentes dos
elétrons de valência.
C) As energias de ionizações dos íons são idênticas
às dos respectivos átomos de origem.
D) Os íons sódio hidratados [Na+1(H2O)n]
constituem um exemplo típico de interações dipolo-dipolo.
E) A energia de ionização do bromo é maior do que a
do cloro, posto que seu raio atômico é maior.
09)
(UFC-2003) A água apresenta-se no estado líquido, à
temperatura ambiente e à pressão atmosférica, e entra em ebulição a uma
temperatura que é cerca de 200 oC mais elevada do que a do ponto de
ebulição previsto teoricamente, na ausência das ligações de hidrogênio. Com
relação às ligações de hidrogênio, assinale a alternativa correta.
A) Ocorrem entre moléculas, onde o átomo de
hidrogênio é ligado covalentemente aos átomos mais eletropositivos, pelos seus
pares de elétrons ligantes.
B) Originam-se da atração entre os átomos de
hidrogênio de uma molécula de água, que têm carga parcial negativa, e o átomo
de oxigênio de uma outra unidade molecular, que tem carga parcial positiva.
C) No
estado sólido, as ligações de hidrogênio presentes na água são mais efetivas,
resultando em efeitos estruturais que conferem menor densidade ao estado sólido
do que ao líquido.
D) Quanto maior for a eletronegatividade do átomo
ligado ao hidrogênio na molécula, maior será a densidade de carga negativa no
hidrogênio, e mais fraca será a interação com a extremidade positiva da outra
molécula.
E) São interações muito mais fortes do que as
ligações covalentes polares convencionais, e desempenham papel fundamental na
química dos seres vivos.
10)
(UFC-2003) Compostos de zinco são largamente utilizados na
indústria cosmética. O óxido de zinco (ZnO), um adstringente típico, é
comumente adicionado aos cosméticos para contrair tecidos e reduzir a camada
oleosa da pele. O peróxido de zinco (ZnO2), utilizado em
desodorantes, tem a capacidade de remover odores, através da oxidação de aminas
e ácidos graxos expelidos na sudorese.Assinale a alternativa correta.
A) As fórmulas empíricas corretas do óxido de zinco
e do peróxido de zinco são ZnO e Zn1/2O, respectivamente.
B) O óxido de zinco e o peróxido de zinco são
espécies químicas alotrópicas e isoeletrônicas.
C) Nos compostos ZnO e ZnO1\2, os
respectivos estados de oxidação do zinco e do oxigênio são idênticos.
D) O óxido de zinco e o peróxido de zinco constituem
exemplos de isômeros geométricos.
E) A
configuração eletrônica do zinco, tal como se apresenta nos compostos ZnO e ZnO2,
é [Ar]3d10
11)
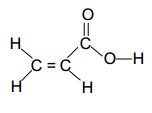
(UFF/1-2000) As ligações químicas nos compostos
orgânicos podem ser do tipo σ ou π. A ligação σ é formada pela interação de
dois orbitais atômicos, segundo o eixo que une os dois átomos, ao passo que na
ligação π, a interação dos orbitais atômicos se faz segundo o plano que contém
o eixo da ligação. Na estrutura representada abaixo, tem-se:
(A) 2 ligações σ e 6 ligações π
(B) 2 ligações σ e 8 ligações π
(C) 4 ligações σ e 4 ligações π
(D) 6 ligações σ e 2 ligações π
(E) 8
ligações σ e 2 ligações π
12)
(UFLA-2001) O sal de cozinha (NaCl), o ácido
clorídrico (HCl) e a glicose (C6H12O6)
apresentam em suas estruturas, respectivamente, ligações do tipo
a) iônica, iônica e iônica.
b) covalente, covalente e covalente.
c) metálica, covalente e covalente.
d) iônica,
covalente e covalente.
e) iônica, metálica e covalente


Sem comentários:
Enviar um comentário