AULA DE ELETRÓLISE
– PARTE 2
12. As Pilhas Comerciais
- As pilhas atuais possuem esse mesmo princípio de funcionamento, em que um metal doa elétrons para outro, por meio de uma solução condutora, e é produzida a corrente elétrica. A diferença é que as pilhas usadas hoje são secas, porque não utilizam como eletrólito uma solução líquida, como ocorre na pilha de Daniell.
Hoje existe uma diversidade muito grande de pilhas que são vendidas comercialmente. Entre elas as mais comuns são as pilhas ácidas (de Leclanché)e as pilhas alcalinas.
Ambas possuem o zinco como o eletrodo negativo; já como polo positivo, há uma barra de grafita instalada no meio da pilha envolvida por dióxido de manganês (MnO2), carvão em pó (C) e por uma pasta úmida. A diferença é que, na pilha ácida, usa-se na pasta úmida o cloreto de amônio (NH4Cl) e cloreto de zinco (ZnCl2) – sais de caráter ácido – além de água (H2O). Já na pilha alcalina, usa-se o hidróxido de potássio (KOH), que é uma base.
(a) pilhas secas (irreversíveis: não recarregáveis)
* de
Leclanché (pilha comum): ânodo de zinco; pasta de MnO2 + KOH H2O; cátodo de carbono.
(b) pilhas de mercúrio-zinco: ânodo de zinco; cátodo de HgO;
(c) bateria de níquel-cádmio (reversível: carregáveis):
ânodo de cádmio; cátodo de Ni(OH)3
; eletrólito KOH(aq).
(d) bateria chumbo- H2SO4 : ânodo de chumbo; cátodo de PbO2; eletrólito H2SO4.
Pb° + PBO2 + 4H+ --------
2 Pb+2 + 2 H2O
Exercício de Fixação
01. Quando uma bateria de
automóveis está em funcionamento a concentração do ácido
(a) aumenta.
(b) diminui.
(c) fica constante.
02. As novas
pilhas (mercúrio-zinco) e baterias (níquel-cádmio) quando
inutilizadas não
devem ser jogadas no ambiente devido a poluição provocada principalmente por:
(a) Hg e KOH
(b) Zn e Ni
(c) Hg e Cd
(d) Zn e KOH
13. A Corrosão Metálica:
Quanto mais
baixo o E° de redução de um metal mais fácil é sua corrosão. Se E° é negativo o
metal é atacado por ácido forte. Quanto mais negativo mais fácil o ataque e a
corrosão.
Exercício de Fixação
01.Qual dos
metais abaixo é atacado por ácidos?
(a) Ag
(b) Au
(c) Cu
(d) Mg
14. A Proteção Catódica e Ânodos de Sacrifício:
Se um metal M é ligado a outro metal M’ que possui E° mais baixo, então:
· M fica
protegido da corrosão (é o cátodo).
· M’ é
o ânodo de sacrifício (sofre corrosão no lugar de M).
Como o aço é
corroído na água do mar?
Para entender a proteção catódica
primeiro é preciso entender o mecanismo da corrosão. Para que a corrosão
ocorra, três condições devem estar presentes.
1. Dois metais diferentes
2. Um eletrólito (água com qualquer tipo de sal ou sais dissolvidos nela)
3. Um caminho metálico (condutivo) entre os metais diferentes
2. Um eletrólito (água com qualquer tipo de sal ou sais dissolvidos nela)
3. Um caminho metálico (condutivo) entre os metais diferentes
Os dois metais diferentes podem ser
ligas totalmente diferentes como aço e alumínio, mas mais frequentemente são
diferenças metalúrgicas micro ou macroscópicas na superfície de uma peça única
de aço. Se as condições acima existirem, na superfície metálica mais ativa
(nesse caso consideraremos o aço sendo corroído livremente, o que não é
uniforme), ocorre a seguinte reação nos locais mais ativos: (2 íons de ferro
mais 4 elétrons livres)
2Fe => 2Fe++ + 4e-
Os elétrons livres viajam pelo caminho
metálico até os locais menos ativos em que ocorre a seguinte reação: (O gás
oxigênio convertido em íons de oxigênio – através da combinação com os quatro
elétrons livres – que se combinam com a água para formar íons de hidroxila)
O2 + 4e- + 2H20 => 4 OH-
As recombinações desses íons na
superfície ativa produzem a seguinte reação, que gera o produto corrosivo de
ferro, o hidróxido ferroso (Ferro combinando com oxigênio e água para formar
hidróxido ferroso):
2Fe + O2 + 2H2O => 2Fe (OH)2
Essa reação é mais comumente explicada
como um fluxo de corrente através da água do anodo (local mais ativo) para o
catodo (local menos ativo).
Como a proteção
catódica interrompe a
corrosão?
corrosão?
Geralmente isso toma a forma de anodos
galvânicos, que são mais ativos do que o aço. Essa prática também é chamada de
sistema sacrificial, pois os anodos galvânicos sacrificam a si mesmos para
proteger o aço estrutural ou a tubulação contra a corrosão.
No caso de anodos de alumínio, a reação
na superfície do alumínio é (4 íons de alumínio mais 12 elétrons livres):
4Al => 4AL+++ + 12 e-
e na superfície do aço (O gás oxigênio
convertido em íons de oxigênio que se combina com a água para formar íons de
hidroxila):
3O2 + 12e- + 6H20 => 12OH-
Desde que a corrente (elétrons livres)
esteja chegando no cátodo (aço) mais rápido do que o oxigênio está chegando,
não ocorre corrosão.
Figura 1: Sistema de PC de anodo de sacrifício em
água do mar
Exercício de Fixação
01. Dos
metais abaixo indicar aqueles que protegem o ferro, funcionando como ânodos de
sacrifício.
Au, Au, Ni, Zn, Mg
15. As Reações Químicas em Solução Aquosa.
· Se
dois sistemas de oxirredução formam um pilha eletroquímica, a reação global da mesma
ocorre espontaneamente quando os reagentes são colocados diretamente em
contato.
Exercício de Fixação
01. Considere as seguintes possibilidades de reação:
Onde ocorre realmente a reação? Por que?
_______________________________________________________________
02.Quais das reações abaixo
ocorre mais facilmente?
Pelo Prof. Eudo Robson
Fontes de Pesquisa:
brasilescola.uol.com.br
www.triplex.com.pt
inpecaoequipto.blogspot.com
www.cathodicprotection101.com
mundodaeducacao.bol.com.br
Livro de Ricardo Feltre- Vol.2 - 2003



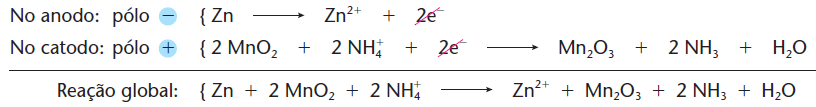












Sem comentários:
Enviar um comentário